
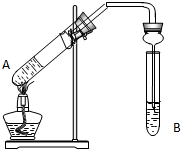
 用如图实验装置制取乙酸乙酯.回答以下问题:
用如图实验装置制取乙酸乙酯.回答以下问题:| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用CaCl2溶液可区别Na2C03和NaHCO3溶液 |
| B、用CC14萃取碘水中的碘 |
| C、用饱和NaHCO3溶液除去C02中的HCl |
| D、检验未知溶液是否含S042-,可先加氯化钡,再加稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定有乙烯 |
| B、一定有甲烷 |
| C、一定没有甲烷 |
| D、一定没有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4mol A+2mol B |
| B、2mol A+1mol B+3mol C+1mol D |
| C、3mol C+1mol D+1mol B |
| D、3mol C+1mol D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 “魔棒”常被用于晚会现场气氛的渲染.其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法正确的是( )
“魔棒”常被用于晚会现场气氛的渲染.其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法正确的是( )| A、CPPO属于芳香烃 |
| B、CPPO属于高分子化合物 |
| C、1mol CPPO与氢氧化钠稀溶液反应(假设苯环上卤素不水解),最多消耗6mol NaOH |
| D、1mol CPPO与氢气完全反应,需要氢气10mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液与PH=10的 Ba(OH)2溶液,溶质的物质的量浓度之比为2:1 |
| B、该溶液由水电离出来的c(H+)与PH=4的NH4Cl溶液相同 |
| C、降低温度,溶液的c(NH4+)/c(NH3?H3O)减小,PH降低 |
| D、往该溶液中加入足量的NH4Cl固体后,c(NH4+)+c(NH3?H3O)=c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com