
| A、WO |
| B、X2O5 |
| C、YO2 |
| D、ZO3 |


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
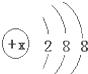 有几种元素的微粒的最外电子层结构如图所示,其中:
有几种元素的微粒的最外电子层结构如图所示,其中:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热蒸干灼烧FeCl3溶液,最后所得固体为Fe(OH)3 |
| B、将pH=4的醋酸溶液稀释后,溶液中所有离子浓度都降低 |
| C、pH相同,体积相同的醋酸溶液和稀硫酸分别与足量锌充分反应,产生氢气的量相同 |
| D、若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| B、NaHSO4溶液与Ba(OH)2溶液混合后显酸性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、FeI2溶液中通入少量Cl2:2 Fe2++Cl2=2 Fe3++2Cl- |
| D、向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰使SO42-沉淀完全NH4++Al3++2Ba2++2SO42-+4OH-=Al(OH)3↓+NH3?H2O+2BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、④③②① |
| C、②①③④ | D、④②③① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、ⅣA族元素的简单氢化物CH4、SiH4、GeH4、SnH4的沸点随相对分子质量增大而升高,可推知VA族元素氢化物的沸点也具有完全同样的变化规律 |
| B、加热Ca(HCO3)2水溶液,低温蒸发至干,最终产物为CaCO3,从而有Mg(HCO3)2水溶液加热蒸发结晶后的最终产物为MgCO3 |
| C、CO2通入CaCl2溶液中无沉淀生成,因此SO2通入BaCl2溶液中也没有沉淀生成 |
| D、AlCl3溶液中加入Na2S的离子方程式为:2Al3++3S2-+6H2O═2Al(OH)3↓+3H2S↑,可知FeCl3溶液中加入Na2S的离子方程式为:2Fe3++3S2-+6H2O═2Fe(OH)3↓+3H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.2g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA |
| B、标准状况下,11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
| C、500℃、30MPa下:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ?mol-1;将1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3kJ |
| D、60 g石英晶体中含有的Si-O键数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有正反应速率增大 |
| B、逆反应速率减小 |
| C、正逆反应速率同时增大 |
| D、正逆反应速率同时减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com