
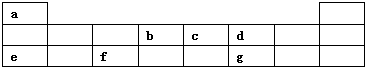
 ,故答案为:第三周期ⅢA族;
,故答案为:第三周期ⅢA族; ;
; ,氨气发生催化氧化生成NO与水,反应方程式为:4NH3+5O2
,氨气发生催化氧化生成NO与水,反应方程式为:4NH3+5O2
| ||
| △ |
 ;4NH3+5O2
;4NH3+5O2
| ||
| △ |
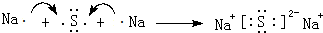 ;a与d组成18电子为H2O2,
;a与d组成18电子为H2O2,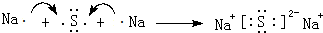 ;H2O2;
;H2O2;
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、①②③④ | B、②④①③ |
| C、①③④ | D、②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K2MnO4、KMnO4、MnO2三者中Mn元素的化合价逐渐升高 |
| B、NaCl、Na2CO3、NaOH三者饱和溶液的pH逐渐变大 |
| C、NH4NO3、NaCl、CaO三者溶于水后,所得溶液的温度逐渐降低 |
| D、金、银、铜金属活动性顺序逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究氮的固定具有重要意义.
研究氮的固定具有重要意义.| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度 |
| B、减小压强 |
| C、使用催化剂 |
| D、增大SO2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时的负极反应为:PbO2+4 H+十2e-=Pb2++2H2O |
| B、充电时,当阳极质量增加23.9 g时溶液中有0.2mo1电子通过 |
| C、放电时,正极区pH增大 |
| D、充电时,Pb电极与电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、甲池中,b电极是负极 |
| B、a电极的电极反应式C2H5OH+16OH--12e-═2CO32-+11H2O |
| C、一段时间后,用湿润淀粉KI试纸靠近乙池d电极变蓝放电 |
| D、乙池在反应前后溶液的pH不变充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Cu与足量稀HNO3反应,转移3nA个电子 |
| B、常温常压下,22.4LCl2含有2nA个Cl原子 |
| C、16gCH4含有10nA个电子 |
| D、1LO.1 mol.L-1Na2SO3溶液中含有O.1nA个S032- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由X、Z、W组成盐的水溶液呈酸性,则溶液中该盐阳离子浓度小于酸根离子浓度 |
| B、气态氢化物的稳定性:W<R<Z |
| C、原子半径:W<Z<Y,而简单离子半径:Y<Z<W |
| D、ZR2、TR2两化合物中R的化合价相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com