
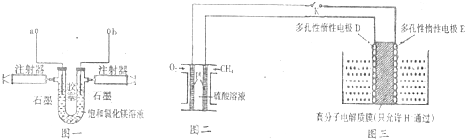
分析 (1)将a、b接上直流电的两极,为电解池装置,阳极生成氯气,阴极生成氢气和氢氧化镁沉淀,待注射器中收集到-定量的气体后断开电源,再用一根导线将a、b连接,此时装置是燃料电池装置,据此回答;
(2)燃料电池的总反应是染料燃烧的过程;
(3)硝酸根离子转化为氮气的过程发生在电解池的阴极上,D是阴极,E是阳极,根据电解池的工作原理来回答.
解答 解:(1)将a、b接上直流电的两极,为电解池装置,阳极生成氯气,阴极生成氢气和氢氧化镁沉淀,即:MgCl2,2H2O$\frac{\underline{\;通电\;}}{\;}$Mg(OH)2+H2↑+Cl2↑,待注射器中收集到-定量的气体后断开电源,再用一根导线将a、b连接,此时装置是氢气和氯气构成的燃料电池装置,化学方程式为H2+Cl2=2HCl,故答案为:两个电极上都会产生气泡,阴极生成氢氧化镁白色沉淀;MgCl2,2H2O$\frac{\underline{\;通电\;}}{\;}$Mg(OH)2+H2↑+Cl2↑;H2+Cl2=2HCl;
(2)在CH4燃料电池中,负极上是燃料发生失电子的氧化反应,正极上是氧气得电子的还原反应,在酸性环境下总反应式为CH4+2O2=CO2+2H2O,
故答案为:为CH4+2O2=CO2+2H2O;
(3)硝酸根离子转化为氮气的过程发生在电解池的阴极上,D是阴极,E是阳极,高分子电解膜中的H+反应移向阴极,即移向D电极,D极的电极反应为
2NO3-+6H2O+10e-=N2↑+12OH-,故答案为:D;2NO3-+6H2O+10e-=N2↑+12OH-.
点评 本题考查了原电池和电解池原理,为高频考点,侧重于学生的分析能力的考查,正确判断原电池和电解池是解本题关键,难点是电极反应式的书写,难度中等.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol乙烷含C-H键的数目为7NA | |
| B. | 1L0.5mol/LNa2S溶液中HS-的数目为0.5NA | |
| C. | 标准状况下,Na与水反应产生22.4 LH2时转移电子数目为2 NA | |
| D. | 含1mol HCOOH的水溶液中含氧原子的总数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ①②④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| A. | 增加Fe2O3固体可以提高CO的转化率 | |
| B. | 该反应的△H<0 | |
| C. | 减小容器体积既能提高反应速率又能提高平衡转化率 | |
| D. | 容器内气体密度恒定时,不能标志反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在100℃、101 kPa条件下,1 mol液态水汽化时需要吸收40.69 kJ的热量,则H2O(g)═H2O(l)的△H=+40.69 kJ•mol-1 | |||||||||
| B. | 已知CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,则CH4的燃烧热△H=-890.3 kJ | |||||||||
| C. | H2(g)+Br2(g)═2HBr(g)△H=-72 kJ•mol-1其他相关数据如表:
| |||||||||
| D. | 已知S(g)+O2(g)═SO2(s)△H1,S(g)+O2(g)═SO2(g)△H2,则△H2<△H1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com