
随着卤素原子半径的增大,下列递变规律正确的是()
A. 单质的熔点逐渐降低 B. 卤素离子还原性逐渐增强
C. 气态氢化物稳定性逐渐增强 D. 单质氧化性逐渐增强
考点: 同一主族内元素性质递变规律与原子结构的关系.
专题: 元素周期律与元素周期表专题.
分析: 根据同一主族元素的性质递变性:从上到下,得电子能力逐渐减弱,气态氢化物稳定性逐渐减弱,金属性逐渐增强,单质氧化性逐渐减弱.
解答: 解:A、卤素原子从上到下原子半径逐渐增大,单质状态从气体过渡到液体再到固体,所以单质的熔点逐渐升高,故A错误;
B、卤素原子从上到下,单质氧化性逐渐减弱,卤素离子还原性逐渐增强,故B正确;
C、卤素原子从上到下,气态氢化物稳定性逐渐减弱,故C错误;
D、卤素原子从上到下,单质氧化性逐渐减弱,故D错误.
故选B.
点评: 本题考查学生元素周期律的应用知识,可以根据所学知识来回答,难度不大.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
.某工厂用硫酸处理氨气尾气,得到铵盐(不同批次得到a、b、c三种不同的铵盐)。称取不同质量的铵盐,加入到固定量的NaOH溶液中并加热,收集氨气,得到如下生成氨气的量与加入铵盐的量关系图:
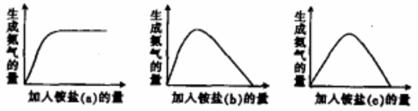
下列判断不正确的是:
A. a对应的铵盐是(NH4)2SO4
B. b对应的铵盐是(NH4)2SO4和NH4HSO4
C. c对应的铵盐是NH4HSO4
D. 当b和c铵盐的质量相同时,可得到相同量的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A、B、C、D、E、F、G相互关系如图所示。5.2 g F能与100 mL 1 mol·L-1的NaOH溶液恰好完全中和,0.1 mol F还能与足量金属钠反应,在标准状况下放出2.24 L H2。D的分子式为C3H3O2Na,E的分子中含有羧基。
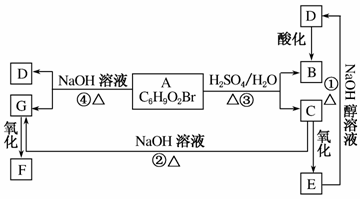
(1)写出下列物质的结构简式:G:________________;F:________________。
(2)化学反应类型:①________________;④________________。
(3)化学方程式:①__________________________;③__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是()
A. 将过量的二氧化碳通入氢氧化钠溶液:CO2+2OH﹣═CO32﹣+H2O
B. 氯化铝溶液中加入过量浓氨水:Al3++4OH﹣═AlO2﹣+2H2O
C. 氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+
D. 碳酸钙和盐酸反应:CO32﹣+2H+═CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化钠(NaH)是一种白色的离子晶体,NaH与水反应放出氢气.下列叙述中,正确的是()
A. NaH在水中显酸性
B. NaH中氢离子的电子层排布与氦原子的相同
C. NaH中氢离子半径比锂离子半径小
D. NaH中氢离子可被还原成氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3.关于该物质的说法正确的是()
A. 该物质属于两性氢氧化物
B. 该物质是Al(OH)3和Na2CO3的混合物
C. 1mol NaAl(OH)2CO3最多可消耗3mol H+
D. 该药剂不适合于胃溃疡患者服用
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B两种烃,它们的组成相同,都约含85.7%的碳,烃A对氢气的相对密度是28;烃B式量比空气的平均式量稍小,且实验式与A相同,烃A、B都能使溴的四氯化碳溶液褪色,根据以上实验事实回答问题.
(1)推断A、B两烃的化学式.A;BC.
(2)A、B中A(填A、B)存在同分异构体,同分异构体的名称是.(有多少写多少)
(3)写出B与溴的四氯化碳溶液反应的化学方程式:.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com