
| A. | ①④ | B. | ②③ | C. | ③④ | D. | ①② |
分析 元素的非金属性越强,其氢化物的稳定性越强,其单质的氧化性氧气,其最高价氧化物的水化物酸性越强(F、O元素除外),其单质与氢气反应越容易,据此分析解答.
解答 解:①往Na2SiO3溶液中通入CO2产生白色沉淀,碳酸和硅酸钠反应生成硅酸,说明碳酸酸性大于硅酸,说明非金属性C>Si,故正确;
②石墨是导体,晶体硅是半导体,与非金属性强弱无关,不能据此判断非金属性强弱,故错误;
③制玻璃过程中发生反应:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,为高温固体之间的反应,不能比较非金属性,故错误;
④CH4比SiH4稳定,说明非金属性C>Si,故正确;
故选A.
点评 本题考查非金属性强弱判断,为高频考点,明确非金属性强弱判断方法是解本题关键,非金属性强弱与得电子难易程度有关,与得电子多少无关,为易错题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
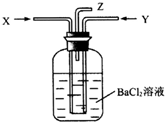 碳跟浓硫酸共热产生的混合气体X(CO2、SO2)和铜跟过量浓硝酸反应产生的气体Y(NO2)同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
碳跟浓硫酸共热产生的混合气体X(CO2、SO2)和铜跟过量浓硝酸反应产生的气体Y(NO2)同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )| A. | 洗气瓶中产生的沉淀是碳酸钡 | B. | 在Z导管出来的气体中无二氧化碳 | ||
| C. | 在Z导管口不会出现红棕色气体 | D. | 洗气瓶中产生的沉淀是硫酸钡 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 废旧显示器必须回收,其主要目的是为了提取其中的贵重金属 | |
| B. | 生活污水中所含的氮、磷化合物是植物营养素,但会导致水体污染 | |
| C. | 二氧化碳和甲烷等会导致“温室效应”,从而引起全球变暖 | |
| D. | 雾霾天气会造成严重的交通问题,雾霾是一种胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 26:9 | B. | 39:9 | C. | 40:9 | D. | 53:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
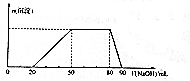 某50 mL溶液中可能含有H+、Na+、NH4+、Mg2+、Al3+、SO42-等离子,当向该溶液中加入5 mol•L-1NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积V(NaOH)变化关系如图所示.下列说法正确的是( )
某50 mL溶液中可能含有H+、Na+、NH4+、Mg2+、Al3+、SO42-等离子,当向该溶液中加入5 mol•L-1NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积V(NaOH)变化关系如图所示.下列说法正确的是( )| A. | 原溶液中一定存在Mg2+、Al3+、H+、SO42- | |
| B. | 原溶液中Al3+的浓度为1mol•L-1 | |
| C. | 原溶液中NH4+的物质的量为0.4mol | |
| D. | 当加入的NaOH的溶液的体积为90mL时,反应后溶液中的离子只有Na+和SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的水溶液是强酸,HBr的水溶液也是强酸 | |
| B. | CO2气体通入Ba(NO3)2溶液中不反应,SO2气体通入Ba(NO3)2溶液中也不反应 | |
| C. | O2与Cu反应生成CuO,S与Cu反应生成CuS | |
| D. | CaCO3与稀硝酸反应生成CO2,CaSO3与稀硝酸反应生成SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
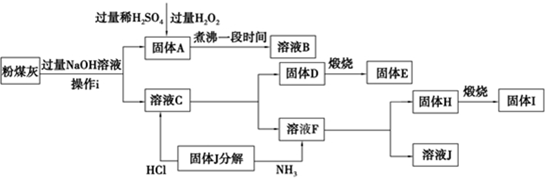
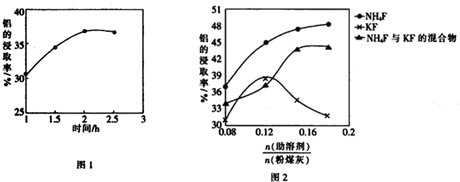
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
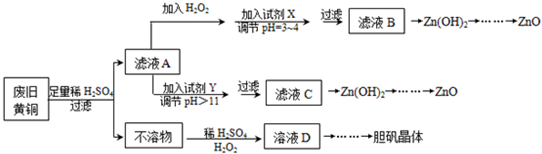
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com