
| A、漂白粉露置在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B、向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| C、向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ |
| D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+ |
| ||


科目:高中化学 来源: 题型:
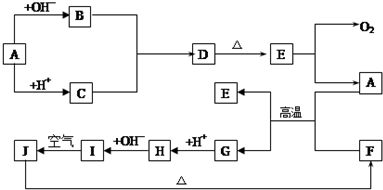
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠固体与水反应:2O2-+2H2O=4OH-+O2↑ | ||
B、在H2O2中加入酸性KMnO4溶液:2M
| ||
| C、醋酸溶液与大理石反应:CaCO3+2H+=Ca2++H2O+CO2↑ | ||
| D、次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60gSiO2晶体中含有2×6.02×1023个Si-O键 |
| B、18gD2O(重水)完全电解,转移2×6.02×1023个电子 |
C、720gC60晶体(如图)中含有6.02×1023个晶胞结构单元 |
| D、14g两种烯烃CnH2n和CmH2m混合物,含有共用电子对数目为3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与水的反应:Na+2H2O=Na++2OH-+H2↑ |
| B、过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| C、硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ |
| D、碳酸钙溶于醋酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、NH4+、Fe2+、NO3-(稀硫酸) |
| B、Al3+、K+、HCO3-、NO3-(NaOH溶液) |
| C、NH4+、Ag+、K+、NO3-(NaOH溶液) |
| D、Na+、K+、AlO2-、SiO32-(稀硝酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:
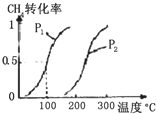 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) | ||
| I | 150 |
|
0.1 | ||
| II | 5 | ||||
| III | 350 | 5 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com