
| A. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-2.92kJ/mol | |
| B. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-0.72kJ/mol | |
| C. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-18kJ/mol | |
| D. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-73kJ/mol |
分析 向H2SO4溶液中加入100mL 0.4mol•L-1 Ba(OH)2溶液反应涉及的离子方程式有Ba2+(aq)+SO42-(aq)=BaSO4(s),H+(aq)+OH-(aq)=H20(l),向足量Ba(OH)2溶液中加入100mL 0.4mol•L-1 HCl溶液时,反应涉及的离子方程式为H+(aq)+OH-(aq)=H20(l),Na2SO4溶液与BaCl2溶液反应的离子方程式为Ba2+(aq)+SO42-(aq)=BaSO4(s),从能量守恒的角度解答.
解答 解:100mL 0.4mol•L-1 Ba(OH)2的物质的量为0.04mol,向H2SO4溶液中加入100mL 0.4mol•L-1 Ba(OH)2溶液反应涉及的离子方程式有Ba2+(aq)+SO42-(aq)=BaSO4(s),H+(aq)+OH-(aq)=H20(l),100mL 0.4mol•L-1 HCl的物质的量为0.04mol,反应涉及的离子方程式为H+(aq)+OH-(aq)=H20(l),根据放出的热量为2.2kJ,
可知H+(aq)+OH-(aq)=H20(l)△H=-$\frac{2.2kJ}{0.04mol}$=-55kJ•mol-1,
设Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-QkJ•mol-1,
则0.04Q+0.08mol×55kJ•mol-1=5.12kJ,解之得Q=18,
所以Na2SO4溶液与BaCl2溶液反应的热化学方程式为Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-18kJ•mol-1.
故选C.
点评 本题考查热化学方程式的书写和反应热的计算,题目难度不大,注意从能量守恒的角度解答该题.


科目:高中化学 来源: 题型:选择题
| A. | 负极反应为:14H2O+7O2+28e-=28OH- | |
| B. | 放电一段时间后,负极周围的pH升高 | |
| C. | 放电过程中OH-向正极移动 | |
| D. | 每消耗1mol C2H6,则电路上转移的电子为14mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
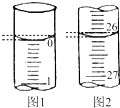 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:| 滴定次数 | 0.1000mol-L-1盐酸的体积/mL | ||
| 滴定前 | 滴定后 | 体积/mL | |
| 1 | 0.10 | 26.21 | 26.11 |
| 2 | 1.56 | 31.30 | 29.74 |
| 3 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开反应釜,将Na 暴露在空气中与氧气反应 | |
| B. | 向反应釜通入Cl2,Na 在Cl2中燃烧生成NaCl | |
| C. | 向反应釜加大量H2O,通过化学反应“除掉”金属钠 | |
| D. | 向反应釜滴加C2H5OH,并设置放气管,排出氢气和热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
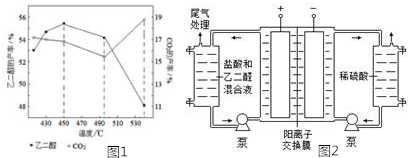
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
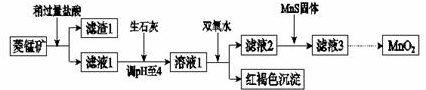
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
 纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
纸置于阳极附近,若试纸变蓝则证明有Cl2生成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10的烯烃 | B. | 分子式为C4H8O2的酯 | ||
| C. | 甲苯(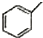 )的一氯代物 )的一氯代物 | D. | 立体烷(  )的二氯代物 )的二氯代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
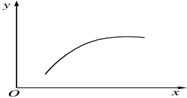 在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)?2C(g)△H<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)?2C(g)△H<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合图中曲线的是( )| 选项 | x | y |
| A | 温度 | 混合气体的平均相对分子质量 |
| B | 压强 | A的百分含量 |
| C | 再通入A | B的转化率 |
| D | 加入催化剂 | A的质量分数 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com