
【题目】化学无处不在,下列说法错误的是( )
A. 《元丰行示德逢》里“雷蟠电掣云滔滔,夜半载雨输亭皋”涉及化学反应N2+O2![]() 2NO
2NO
B. 根据化学学科核心素养之一(证据推理与模型认知)可推知Cr(OH)3胶体也可吸附悬浮杂质
C. 纳米铁粉可以高效地去除污水中的重金属离子是因为其具有较强的还原性
D. 二氧化硅广泛用于制作光导纤维,光导纤维遇强酸强碱都会“断路”
【答案】D
【解析】
A.此诗含义:电闪雷鸣,翻滚的乌云如大海的怒涛。大雨倾盆,打破了深夜的寂静,千里沃野解除了旱情。诗中主要涉及“雷雨发庄稼”,这是由于在放电条件下,空气中的氧气和氮气化合生成了氮的氧化物,氮的氧化物再经过复杂的化学变化,最后生成了易被农作物吸收的硝酸盐。N2+O2![]() 2NO;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO硝酸又和别的不溶盐类反应生成可溶的硝酸盐,故A正确;
2NO;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO硝酸又和别的不溶盐类反应生成可溶的硝酸盐,故A正确;
B.氢氧化铬属两性氢氧化物,与氢氧化铝类似,Cr(OH)3胶体也可吸附悬浮杂质,故B正确;
C.利用纳米铁粉的还原性去除水体中的Cu2+、Hg2+等重金属离子,故C正确;
D.二氧化硅具有良好的光学特性,是制造光导纤维主要原料,能够与氢氧化钠等强碱反应,遇强碱会“断路”,但是二氧化硅不与除氢氟酸以外的酸起反应,故遇强酸不会“断路”,故D错误。
答案:D


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一种“全氢电池”的工作原理如图所示。下列说法不正确的是

A. 电子流向是从吸附层M通过导线到吸附层N
B. Na+从左边穿过离子交换膜向右边移动
C. 离子交换膜可用质子交换膜
D. 负极的电极反应是:H2-2e-+2OH-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产或实验事实引出的相应结论不正确的是( )
选项 | 事实 | 结论 |
A | 工业制硫酸中,在矿石处理阶段,将矿石粉碎再煅烧 | 增大反应物的接触面积,加快化学反应速率 |
B | A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入MnO2,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
C | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
D | 一定条件下:H2(g)+I2(g) | c(I2)增大,I2物质的量增多 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是锌、铜和硫酸溶液构成的原电池。
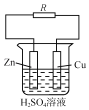
(1)Zn为原电池的_____极;Cu为原电池的_____极。
(2)该原电池中电子的流向为_____→R→_____。
(3)电极反应式:正极_____。负极_____。总方程式为:_____。
(4)反应一段时间后,可观察到的现象为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将BaO2放入密闭的真空容器中,反应2BaO2(s)![]() 2BaO(s)+O2(g)达到平衡,保持温度不变,缩小一半容积,体系重新达到平衡,下列说法不正确的是( )
2BaO(s)+O2(g)达到平衡,保持温度不变,缩小一半容积,体系重新达到平衡,下列说法不正确的是( )
A. 气体的平均摩尔质量不变 B. BaO量减小
C. BaO2的转化率减小 D. 容器中气体浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物中间体的合成路线如下。下列说法正确的是

A. 1mol对苯二酚与足量H2加成,消耗3molH2
B. 2, 5-二羟基苯乙酮不能使酸性KMnO4溶液褪色
C. 2, 5-二羟基苯乙酮中所有碳原子一定处于同一平面
D. 中间体分子中含有的官能团之一是碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程可以达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 配制0.100mol·L-1氨水 | 用量筒量取10.0mL5.00mol·L-1氨水于烧杯中,加入少量蒸馏水稀释,转移至500 mL容量瓶中定容 |
B | 探究SO2的还原性 | 向盛有2mLH2S溶液的试管中缓慢通入SO2,观察是否有沉淀生成 |
C | 制取并纯化溴苯 | 向FeBr3固体中慢慢加入Br2的苯溶液,充分反应后经水洗、Na2SO3溶液洗、水洗、分液、干燥,然后蒸馏 |
D | 比较两种黑色固体FeS和CuS的溶度积 | 向物质的量浓度相同的FeCl2和CuCl2的混合溶液中不断加入Na2S溶液,观察沉淀颜色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)H2SO4的相对分子质量为______,它的摩尔质量为______.
(2)在标准状况下,0.5mol任何气体的体积都约为______.
(3)4g H2与22.4L(标况)CO2相比,所含分子数目较多的是______.
(4)0.01mol某气体的质量为0.28g,该气体的摩尔质量为______,在标准状况下,该气体的体积是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期A,B,C三种元素,原子序数依次增大,A元素的单质是密度最小的气体,B获得2个电子可达到稳定结构,C与A同主族。
(1)判断A,B,C各为何种元素。A____,B____,C____。
(2)用电子式表示三种元素原子之间可能构成的化合物的形成过程,若含共价键请指出共价键是σ键还是π键,并标明该键的个数。
①A与B:___________________________________________________。
②A与C:___________________________________________________。
③B与C:___________________________________________________。
④A,B,C:___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com