
| A. | 只有② | B. | ②④ | C. | ③④ | D. | ①② |
分析 ①KClO3可分解生成KCl;
②SiO2与水不反应;
③Fe(OH)2可被氧化生成Fe(OH)3;
④Na在氧气中燃烧生成Na2O2.
解答 解:①KClO3可分解生成KCl,可一步生成,故正确;
②SiO2先转化为Na2SiO3,然后再转化为H2SiO3,SiO2+2NaOH=Na2SiO3+H2O、Na2SiO3+2HCl=2NaCl+H2SiO3↓,所以不能一步实现转化,故错误;
③Fe(OH)2可与氧气反应被氧化生成Fe(OH)3,故正确;
④Na在氧气中燃烧生成Na2O2,故正确.
故选A.
点评 本题考查物质之间转化,为高频考点,侧重考查学生的分析能力,明确物质的性质是解本题关键,熟记元素化合物知识,知道硅酸的制取方法,题目难度不大.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:解答题
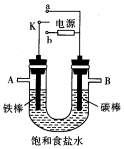 根据如图装置进行电化学的相关实验,回答下列问题.
根据如图装置进行电化学的相关实验,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
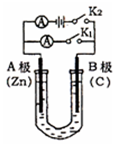 如图所示,U形管内盛有200mL的溶液,按要求回答下列问题.
如图所示,U形管内盛有200mL的溶液,按要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S2O3 (aq)+2HCl(aq)=2NaCl(aq)+S(s)+SO2(g)+H2O(l)在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反 应方向移动 | |
| B. | 若在恒容容器中发生反应:N2(g)+3H2(g)?2NH3 (g),达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 | |
| C. | 在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率一时间图象可用图一表示 | |
| D. | 若在恒压容器中发生反应:2SO3 (g)?2SO2 (g)+O2 (g),达到平衡后再充人适量He,其速率一时间图象可用图二表示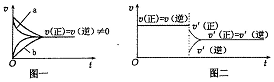 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+与N3-的电子层结构都与氩原子相同 | |
| B. | Na3N中的Na+的半径大于N3-的半径 | |
| C. | Na3N与盐酸反应可生成两种盐 | |
| D. | Na3N与水的反应属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaOH溶液吸收尾气中的氯气:Cl2+4OH-═2ClO-+2H2O | |
| B. | SO2饱和溶液中NH4+、K+、CO32-、SO32-可大量存在 | |
| C. | 2Fe3++Fe═3Fe2+成立,说明氧化性:Fe3+>Fe2+ | |
| D. | 向NaHS溶液中加入适量硝酸发生反应:HS-+H+═H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1 KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42- | |
| C. | 在无色透明溶液中:Ba2+、Ca2+、NO3-、Cl- | |
| D. | 0.1 mol•L-1 FeCl3溶液:K+、NH+4、I-、SCN- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com