
| A.CH3 COOH的电离平衡常数增大为原来的10倍 |
| B.CH3 COO一与CH3 COOH的浓度之比增大为原来的10倍 |
| C.CH3 COO一与H十的浓度之积减小为原来的0.1 |
| D.CH3 COOH与CH3 COO—的浓度之和减小为原来的0.1 |
科目:高中化学 来源:不详 题型:单选题
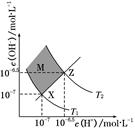
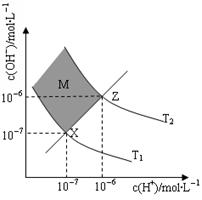
| A.两条曲线间任意点均有c(H+)×c(OH-)=KW |
| B.M区域内任意点均有c(H+)<c(OH-) |
| C.图中T1<T2 |
| D.XZ线上任意点均有pH=7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
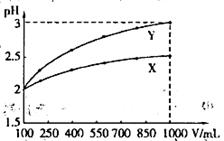
A.X为弱酸,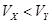 | B.Y为强酸,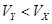 |
C.X为强酸,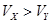 | D.Y为弱酸,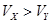 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中导电粒子的数目增加,导电性增强 |
| B.醋酸的电离程度增大,c(H+)亦增大 |
| C.再加入10 m L pH="11" NaOH溶液,混合液pH=7 |
D.溶液中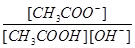 不变 不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小 |
| B.升高温度可以促进醋酸电离,而升高温度会抑制醋酸钠水解 |
| C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离 |
| D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离 |
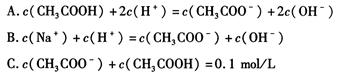
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(NH4+):③>① |
| B.水电离出的c(H+):②>① |
| C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O) |
| D.①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3COO-+H+ ΔH>0
CH3COO-+H+ ΔH>0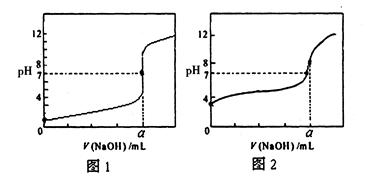
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③④① | B.②①③④ | C.③②④① | D.③②①④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com