
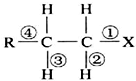
| A. | 发生水解反应时,被破坏的键是①和③ | |
| B. | 发生消去反应时,被破坏的键是①和③ | |
| C. | 发生水解反应时,被破坏的键是③ | |
| D. | 发生消去反应时,被破坏的键是①和② |
分析 该有机物含有卤素原子取代基-X,可发生取代反应,若-X所在碳原子的邻位碳原子上有氢原子,可发生消去反应,结合该有机物的结构特点解答该题.
解答 解:A、当该卤代烃发生水解反应时,-X被取代生成-OH,被破坏的键是①,故A错误;
B、当该卤代烃发生消去反应时,被破坏的键是①和③,生成碳碳双键和HX,故B正确;
C、当该卤代烃发生水解反应时,-X被取代生成-OH,被破坏的键是①,故C错误;
D、当该卤代烃发生消去反应时,被破坏的键是①和③,生成碳碳双键和HX,故D错误;
故选:B.
点评 本题侧重于有机物知识的综合考查,注意把握有机物官能团的性质,特别是有机物的性质与结构特点的关系,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
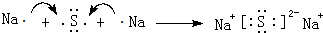 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.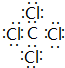 ,该化合物是由极性(填“极性”“非极性”下同)键形成的.
,该化合物是由极性(填“极性”“非极性”下同)键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2 C6H5ONa+H2O+CO2→2 C6H5OH+Na2CO3 | |
| B. | C6H5ONa+H2O+CO2→C6H5OH+NaHCO3 | |
| C. | C6H5OH+Na2CO3→C6H5ONa+NaHCO3 | |
| D. | C6H5OH+NaHCO3→C6H5ONa+H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
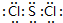 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和乙醇的混合液(3:1)加热至140℃ | |
| B. | 浓硫酸和苯的混和液加热至80℃ | |
| C. | 煮沸氯乙烷和苛性钾溶液 | |
| D. | 煮沸氯乙烷和苛性钾的醇溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X>Y,则酸性:HA>HB | |
| B. | 若X=Y,则HB一定是强酸 | |
| C. | 若酸性:HA<HB,则X和Y关系不确定 | |
| D. | 若由水电离出的H+的浓度:(I)>(Ⅱ),则是X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
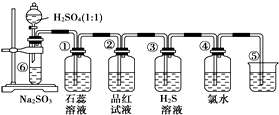 如图是实验室制备SO2并验证SO2某些性质的装置图.
如图是实验室制备SO2并验证SO2某些性质的装置图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.52 |
| 2 | 20.00 | 1.20 | 21.18 |
| 3 | 20.00 | 0.80 | 24.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com