

分析 I.要检验FeO,应该先将FeO转化为亚铁离子,亚铁离子具有还原性,酸性高锰酸钾溶液能氧化亚铁离子而褪色,然后将亚铁离子用酸性KMnO4溶液检验;
Ⅱ.(1)盛放盐酸的仪器为分液漏斗;先分析实验方案,利用装置B除去空气中的二氧化碳,然后用空气将装置D产生的二氧化碳完全赶到装置A中,为了避免空气中水和二氧化碳干扰,装置A需要连接吸收二氧化碳和水的装置,据此对装置进行排序;
(2)根据通入空气还可以将碳酸钙与盐酸反应生成的二氧化碳驱赶到装置B中分析;
(3)空气中含有二氧化碳,会影响实验测定,需要用氢氧化钠溶液吸收;
(4)由于反应生成的二氧化碳中含有杂质氯化氢和水,导致测定的装置A的质量差增大,测定碳酸钙质量偏大,氧化铁的质量分数偏低.
解答 解:I.要检验FeO,应该先将FeO转化为亚铁离子,亚铁离子具有还原性,酸性高锰酸钾溶液能氧化亚铁离子而褪色,高锰酸钾溶液具有强氧化性,能氧化盐酸,所以不能用盐酸酸化高锰酸钾,其检验方法为:取少量样品于试管中,加入稀硫酸溶解,再加入少量KMnO4溶液,溶液不褪色,说明样品中没有FeO,
故答案为:取少量样品于试管中,加入稀硫酸溶解,再加入少量KMnO4溶液,溶液不褪色,说明样品中没有FeO;
Ⅱ.(1)根据图示可知,盛放盐酸的装置为分液漏斗;测定样品中Fe2O3的质量分数,先根据碳酸钙产生的二氧化碳的质量计算出碳酸钙的质量,再根据样品质量计算出氧化铁的质量分数,仪器连接顺序为:先将空气通入盛有氢氧化钠溶液的装置B,以便除去空气中的二氧化碳,然后利用空气将装置D中产生的二氧化碳驱赶到装置A,利用二氧化碳与氢氧化钡生成的碳酸钡沉淀的质量计算出碳酸钙的质量,由于空气中的二氧化碳、水蒸气影响测定结果,需要在装置A后连接一个吸收二氧化碳、水蒸气的装置C,所以装置连接顺序为:BDAC,
故答案为:分液漏斗;B;D;A;C;
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物达到充分反应外,还可以使反应生成的二氧化碳尽可能彻底的赶入装置A中,使反应生成的二氧化碳能够被氢氧化钡溶液完全吸收,
故答案为:将D中生成的CO2全部赶入A装置中,使之完全被Ba(OH)2溶液吸收;
(3)空气中含有二氧化碳,会影响实验测定,而装置B中应该盛放氢氧化钠溶液,从而吸收空气中的二氧化碳,避免空气中的二氧化碳影响测定结果,故d正确,
故答案为:d;
(4)由于装置D生成的二氧化碳中混有氯化氢和水,导致装置A在吸收反应产生的气体前后的质量差偏大,测定的二氧化碳的质量偏大,碳酸钙的质量会偏大,样品中氧化铁的质量偏小,氧化铁的质量分数会偏小,
故答案为:偏小.
点评 本题考查物质成分检验实验方案设计,为高频考点,明确物质性质是解本题关键,涉及亚铁离子检验、实验操作、误差分析等知识点,根据实验目的确定实验操作先后顺序,知道各个仪器作用,注意:不能用盐酸酸化高锰酸钾,为易错点,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 某金属元素气态基态原子的逐级电离能的数值分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X3+ | |
| B. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4$→_{高温}^{H_{2}}$Si均能一步实现 | |
| C. | 33gCH≡C-CH=CH-CH3中所含的π键数、12g石墨中所含的碳碳键数均为1.5mol | |
| D. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,可能含有K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与乙炔 | B. | 丙烷与乙炔 | C. | 丙烯与丁烯 | D. | 乙烷与丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ Fe3+ SO42- NO3- | B. | K+ Na+ CO32- NO3- | ||
| C. | K+ NH4+ OH- SO42- | D. | Na+ K+ AlO2- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 没有洗涤烧杯和玻璃棒 | |
| B. | 转移溶液时不慎有少量洒到容量瓶外面 | |
| C. | 容量瓶不干燥,含有少量蒸馏水 | |
| D. | 定容时俯视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
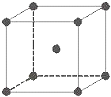 金属铁晶体为体心立方堆积(如图),实验测得铁的密度为ρ(g•cm-3).已知铁的相对原子质量为a,阿伏加德罗常数为NA(mol-1).
金属铁晶体为体心立方堆积(如图),实验测得铁的密度为ρ(g•cm-3).已知铁的相对原子质量为a,阿伏加德罗常数为NA(mol-1).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
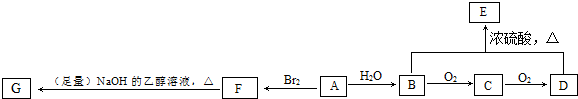
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
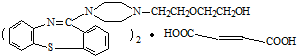 ,它的合成路线如下:
,它的合成路线如下: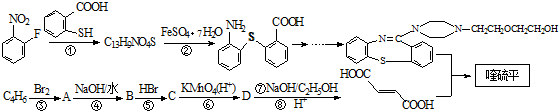
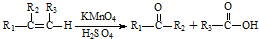
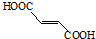 含有的官能团名称为碳碳双键和羧基.
含有的官能团名称为碳碳双键和羧基.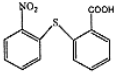 .
.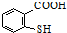 在一定条件下发生缩聚反应的化学方程式为
在一定条件下发生缩聚反应的化学方程式为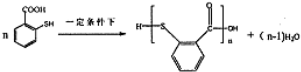 .
.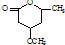 是一种重要的有机化合物.请设计合理方案,完成从
是一种重要的有机化合物.请设计合理方案,完成从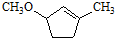 到
到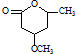 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com