
| A. | O2>MnO2>KMnO4 | B. | KMnO4>MnO2>O2 | C. | MnO2>KMnO4>O2 | D. | O2>MnO2>KMnO4 |
分析 根据反应条件判断反应的难易程度,反应条件越少的氧化还原反应越容易发生,越容易发生的氧化还原反应氧化剂的氧化性越强,据此分析解答.
解答 解:根据方程式①4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O、②2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O、③4HCl(g)+O2$\frac{\underline{\;催化剂\;}}{△}$2Cl2+2H2O(g)知,②没有反应条件,①的反应条件是加热,③的反应条件是加热和催化剂,反应条件越少的氧化还原反应越容易发生,越容易发生的氧化还原反应氧化剂的氧化性越强,所以氧化性最强的是高锰酸钾,其次是二氧化锰,最后是氧气,故选B.
点评 本题考查了氧化剂氧化性强弱的判断,根据“反应条件越少的氧化还原反应越容易发生,越容易发生的氧化还原反应氧化剂的氧化性越强”来解答即可,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
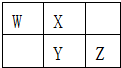 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可使湿润的红色石蕊试纸变蓝,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可使湿润的红色石蕊试纸变蓝,由此可知( )| A. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | W元素形成的单核阴离子半径小于X元素形成的单核阴离子半径 | |
| D. | Z元素单质在化学反应中只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常状况下,1g氢气燃烧生成液态水时放出142.9kJ的热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| B. | 已知H2(g)+F2(g)═2HF(g),△H=-270kJ/mol,则1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ | |
| C. | 500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)$?_{催化剂}^{高温、高压}$2NH3(g),△H=-38.6kJ/mol | |
| D. | 已知:①C(s石墨)+O2(g)═CO2(g),△H=-393.5kJ/mol,②C(s,金刚石)+O2(g)═CO2(g),△H=-395.0kJ/mol,则C(s,金刚石)═C(s,石墨),△H=-1.5kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
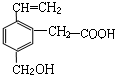 某有机物的结构简式如图,该物质应有的化学性质是( )
某有机物的结构简式如图,该物质应有的化学性质是( )| A. | ①②③⑥ | B. | ②③④⑥ | C. | ①②③④⑤⑥⑦ | D. | ②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | CS2 | C. | H2S | D. | SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com