下列各组数据中,其比值为2:1的是( )
A.相同温度下,0.2mol?L-1乙酸溶液与0.1mol?L-1乙酸溶液中c(H+)之比
B.氨水与(NH4)2SO4溶液混合所得pH=7的溶液中,c(NH+4):c(SO2-4)
C.Na2CO3溶液中,c(Na+):c(CO2-3)
D.pH=12的BA(OH)2溶液与pH=12的KOH溶液中,c[BA(OH)2]:c(KOH)
【答案】分析:A、弱酸的电离程度规律:越稀越电离;
B、溶液显中性,则溶液中的氢离子和氢氧根浓度相等,根据电荷守恒来回答;
C、碳酸根是弱离子,在溶液中会水解;
D、根据氢氧化钡和氢氧化钾中能电离出的氢氧根离子的量来回答.
解答:解:A、弱酸的电离程度规律:越稀越电离,相同温度下,0.2mol?L-1乙酸溶液的电离程度不如0.1mol?L-1乙酸溶液的电离程度大,所以两溶液中c(H+)之比小于2:1,故A错误;
B、pH=7的溶液中,溶液显中性,则溶液中的氢离子和氢氧根浓度相等,根据电荷守恒:c(H+)+c(NH+4)=2c(SO2-4)+c(OH-),所以c(NH+4):c(SO2-4)=2:1,故B正确;
C、Na2CO3溶液中,碳酸根是弱离子,在溶液中会水解,所以c(Na+):c(CO2-3)>2:1,故C错误;
D、pH=12的Ba(OH)2溶液中,氢氧根浓度为0.01mol/L,所以与pH=12的KOH溶液中,c[Ba(OH)2]=0.005mol/L,pH=12的KOH溶液中,氢氧根浓度为0.01mol/L,c(KOH)=0.01mol/L,所以c[Ba(OH)2]:c(KOH)=1:2,故D错误.
故选B.
点评:本题考查学生盐的水解、溶液中的电荷守恒以及弱电解质的电离等方面知识,考查角度广,难度中等.



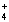 ) 与c(SO
) 与c(SO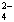 ) 之比
) 之比![]() )之比
)之比