

| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al (OH)3 |
| 开始沉淀时的pH | 7.0 | 1.9 | 3.4 |
| 完全沉淀时的pH | 9.0 | 3.2 | 4.7 |
| 实验操作 | 现象 | 结论 |
| 取适量产品于洁净烧杯中,加入适量蒸馏水,充分搅拌,静置,滤去沉淀. | 得黄棕色溶液 | |
| 取少量溶液于试管中,滴加溶液 ①0.05mol/L酸性高锰酸钾; | ②溶液不褪色; | 溶液中不含Fe2+ |
| 取少量溶液于试管中,滴加0.1 mol/L BaCl2溶液,再滴加20% HNO3溶液 | ③产生白色沉淀; | 溶液中含有SO${\;}_{4}^{2-}$ |
分析 (1)依据氢氧化铁胶体具有吸附悬浮杂质的作用分析净水原理;
(2)沉淀完全时溶解时溶液中金属离子的浓度为1.0×10-5mol/L,氢氧化亚铁完全沉淀的PH=9,结合离子积常数和溶度积常数计算得到;加入少量NaHCO3调溶液pH=6的目的是把溶液中的铝离子全部沉淀;
(3)流程分析反应Ⅱ是亚硝酸钠在酸溶液中氧化亚铁离子为铁离子,依据氧化还原反应电子守恒和电荷守恒,原子守恒配平写出;依据氧化还原反应电子守恒计算;
(4)证明不含有亚铁离子需要选择高锰酸钾溶液褪色与否进行实验验证,证明含有硫酸根离子的实验是依据硫酸根离子检验方法选择试剂检验,根据提供的试剂需要选择氯化钡溶液和稀硝酸.
解答 解:(1)碱式硫酸铁能够净水的原因是,碱式硫酸铁在溶液中铁离子水解生成了具有较强吸附能量的氢氧化铁胶体,吸附悬浮在水中杂质的起到净水作用;
故答案为:能水解生成具有吸附能力较强的胶体;
(2)沉淀完全时溶解时溶液中金属离子的浓度为1.0×10-5mol/L,氢氧化亚铁完全沉淀的PH=9,c(H+)=10-9mol/L,c(OH-)=10-5mol/L,依据溶度积常数计算方法得到Ksp=c(Fe2+)c2(OH-)=1.0×10-5mol/L×(10-5mol/L)2=1×10-15(mol/L)3;加入少量NaHCO3调溶液pH=6的目的是把溶液中的铝离子全部沉淀;
故答案为:1×10-15(mol/L)3;调节溶液PH促进Al3+水解转化为沉淀除去;
(3)分析反应Ⅱ是亚硝酸钠在酸溶液中氧化亚铁离子为铁离子,依据氧化还原反应电子守恒和电荷守恒,原子守恒写出的离子方程式为:Fe2++2H++NO2-=Fe3++NO↑+H2O;在实际生产中,常同时通入O2以减少反应II中NaNO2的用量.若实际生产中需要节约1.38t的NaNO2用量,物质的量=$\frac{1.38t}{69g/mol}$=2×104mol,转移电子2×104mol,依据电子守恒计算:
4NaNO2~4NO~4e-~O2~4e-
4 1
2×104mol n(O2)
n(O2)=5×103mol
V(O2)=5×103mol×22.4mol/L=1.12×105L=112m3;
则应通入标准 状况下的02 的体积为112m3;
故答案为:Fe2++2H++NO2-=Fe3++NO↑+H2O;112;
(4)根据提供的试剂设计实验检验所得产品中不含 Fe2+,含有SO42-,实验证明不含有亚铁离子需要选择高锰酸钾溶液褪色与否进行实验验证,证明含有硫酸根离子的实验是依据硫酸根离子检验方法选择试剂检验,具体步骤为:取适量产品于洁净烧杯中,加入适量蒸馏水,充分搅拌,静置,滤去沉淀,得黄棕色溶液,取少量溶液于试管中,滴加0.05mol/l的酸性高锰酸钾溶液,溶液不褪色证明溶液中不含Fe2+,取少量溶液于试管中,滴加0.1mol/L的BaCl2 溶液,再加入20% HNO3 溶液,白色沉淀,溶液中含有SO42-;
故答案为:
| 操 作 | 现 象 |
| 0.05 mol/L酸性高锰酸钾溶液 | 溶液不褪色 |
| 产生白色沉淀 |
点评 本题考查了实验制备物质的分析应用,离子检验方法和设计,化学方程式,氧化还原反应电子守恒的计算式解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
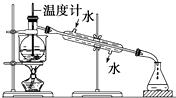 (1)从含碘的有机溶液中提取碘和回收有机溶剂,需要经过蒸馏,指出下面蒸馏装置图中的错误之处.
(1)从含碘的有机溶液中提取碘和回收有机溶剂,需要经过蒸馏,指出下面蒸馏装置图中的错误之处.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:
.某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水溶性 |
| 水杨酸 | 132 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 与水反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
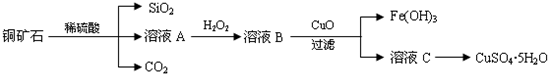
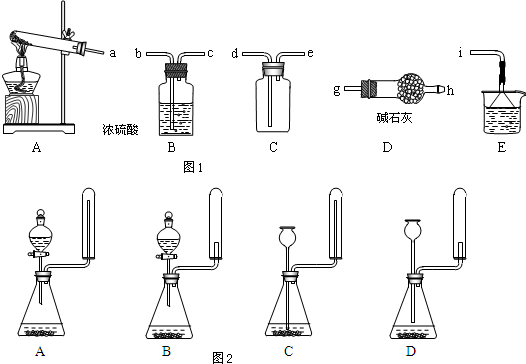
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
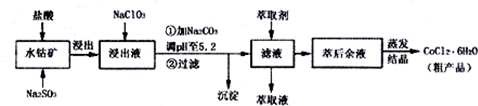
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN | B. | CH3COOH | C. | HF | D. | HNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱电解质需要通电才能发生电离 | |
| B. | 醋酸达到电离平衡时,不存在:CH3COO-+H+?CH3COOH | |
| C. | H2SO4是共价化合物,所以它是弱电解质 | |
| D. | 电离平衡右移,电解质分子的浓度不一定减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com