
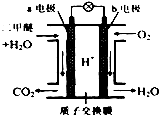
 二甲醚是一种绿色、可再生的新能源.图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )
二甲醚是一种绿色、可再生的新能源.图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )| A. | a电极为该电池负极 | |
| B. | 电池工作时,燃料电池内部H+从a电极移向b电极 | |
| C. | 电池工作时,a电极反应式:CH3OCH3-12e-+3H2O═2CO2↑+12H+ | |
| D. | O2在b电极上得电子,电极反应式:O2+4e-+2H2O═4OH- |
分析 氧气得电子,化合价降低,故b电极是正极,电极反应式:O2+4e-+4H+═2H2O;由图知在a电极二甲醚与水反应生成二氧化碳和氢离子,故a电极的反应式为(CH3)2O-12e-+3H2O=2CO2+12H+,据此分析解答.
解答 解:A.通燃料的a极,失电子,为负极,故A正确;
B.a极为负极,二甲醚放电生成二氧化碳,由离子交换膜可知还生成氢离子,H+从a负极移向b正极,故B正确;
C.在a电极二甲醚与水反应生成二氧化碳和氢离子,故a电极的反应式为(CH3)2O-12e-+3H2O=2CO2+12H+,故C正确;
D.O2在b电极上得电子,被还原,电极反应式:O2+4e-+4H+═2H2O,故D错误.
故选D.
点评 本题考查原电池工作原理,题目难度不大,会书写电极反应式是解题的关键.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:解答题

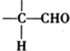 $\stackrel{稀氢氧化钠溶液}{→}$
$\stackrel{稀氢氧化钠溶液}{→}$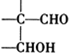 -CHO+
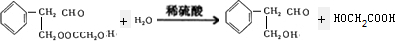
-CHO+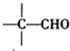 +NaOH(浓)→
+NaOH(浓)→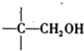 +
+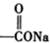
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
 或
或 ;由②、④两种元素形成的一种气体会产生温室效应,其电子式为:
;由②、④两种元素形成的一种气体会产生温室效应,其电子式为: .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A2+3B2═2AB3 | B. | 2AB2+B2═2AB3 | C. | 2A2B+5B2=4AB3 | D. | 2AB2+B2=2AB3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0、△S>0的反应在任何温度下都不能自发进行 | |
| B. | 反应NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1之所以能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均不能单独作为反应自发性的判据 | |
| D. | 在其它外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 | |
| B. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 | |
| C. | 在一个基态多电子的原子中,M层上的电子能量肯定比N层上的电子能量低 | |
| D. | 在一个基态多电子的原子中,如果某一能级上有多个未成对电子,它们自旋方向必然相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | △H | |||
| ① | 50 mL 0.50 mol•L-1 NaOH溶液 | 50 mL 0.55 mol•L-1 HCl溶液 | 20℃ | 23.2℃ | |
| ② | 50 mL 0.50 mol•L-1 NaOH溶液 | 50 mL 0.55 mol•L-1 HCl溶液 | 20℃ | 23.4℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 加水 | C. | 改用98%的浓硫酸 | D. | 加入NaHCO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com