
| A. | Na2O2具有强的氧化性,可以做供氧剂 | |
| B. | Na2CO3溶液呈碱性,可以清除餐具表面的油污 | |
| C. | 晶体硅熔点高、硬度大,可用于制作半导体材料 | |
| D. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 |
分析 A.Na2O2能和H2O、CO2反应生成氧气而作供氧剂;
B.Na2CO3能水解生成碱而促进油脂水解;
C.Si元素位于金属和非金属元素之间,是良好的半导体材料;
D.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护.
解答 解:A.Na2O2能和H2O、CO2反应生成氧气而作供氧剂,与过氧化钠的强氧化性无关,故A错误;
B.Na2CO3是强碱弱酸盐,CO32-水解生成NaOH而导致其水溶液呈碱性,从而促进油脂水解,故B正确;
C.硅元素位于金属和非金属元素之间,具有金属和非金属的性质,所以是良好的半导体材料,与Si的熔沸点高低无关,故C错误;
D.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护,要使海轮外壳上Fe被保护需要将Fe作原电池正极,则需要的金属应该比Fe活泼,如Zn等,故D错误;
故选B.
点评 本题考查物质的组成、结构和性质,为高频考点,侧重考查学生分析判断能力,明确常见元素化合物性质、化学反应原理是解本题关键,结构决定性质、性质决定用途.


科目:高中化学 来源: 题型:解答题
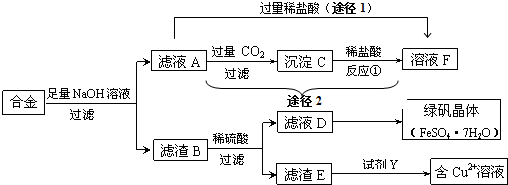
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每生成1mol Fe3O4,反应转移的电子总数为3mol | |
| B. | Fe2+和S2O32-都是还原剂 | |
| C. | 1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为$\frac{1}{3}$mol | |
| D. | x=6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
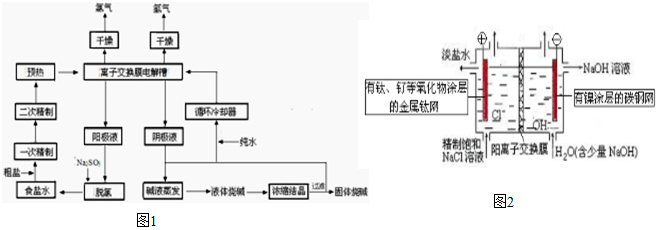
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2>△H3 | B. | △H2<△H1<△H3 | C. | △H1=△H2=△H3 | D. | △H1>△H3>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
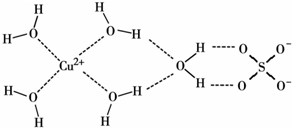
 .
.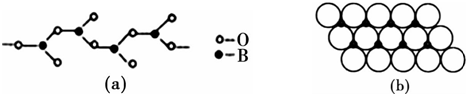
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
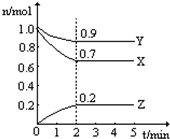 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com