
【题目】工业上用钛白渣[主要成分为FeSO4,还含有少量Fe2(SO4)3、MgSO4及TiOSO4]为主要原料生产氧化铁黄(FeOOH)的一种工艺流程如下:
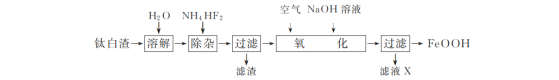
(1)“溶解”时,TiOSO4发生水解生成难溶于水的H2TiO3,反应的化学方程式为________。
(2)“除杂”时,加入NH4HF2固体的作用是________。
(3)“氧化”时,Fe2+生成FeOOH的离子方程式是________。
(4)滤液X中主要含有的阳离子是________(填化学式)。
(5)实验测得反应溶液的pH、温度对氧化铁黄产率的影响如图所示。
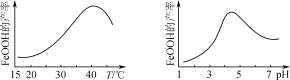
①反应温度宜选择________。
②氧化时应控制pH的合理范围是4.5左右,pH过小或过大均会导致氧化铁黄产率较低,其可能原因是__________________________________。
【答案】TiOSO4+2H2O=H2TiO3↓+H2SO4 除去Mg2+ 4Fe2++O2+8OH-=4FeOOH↓+2H2O Na+、NH4+ 40 ℃ pH过低导致氧化铁黄部分溶于酸,pH过大导致Fe(OH)3增多
【解析】
(1)TiOSO4水解生成难溶于水的H2TiO3和硫酸;
(2)NH4+水解使溶液显弱碱性;
(3)碱性条件下Fe2+与空气中的氧气结合生成FeOOH;
(4)向溶解的钛白渣中加入NH4HF2固体,除去了Mg2+,向过滤后的溶液中加入氢氧化钠溶液并通入空气,除去了铁元素,此时判断滤液中的阳离子;
(5)根据温度与FeOOH产率的示意图可确定反应的适宜温度;溶液酸性过强FeOOH部分溶解,碱性过强,Fe(OH)3增多。
(1)TiOSO4水解生成难溶于水的H2TiO3和硫酸,反应方程式为:TiOSO4+2H2O=H2TiO3↓+H2SO4;
(2)NH4+水解使溶液显弱碱性,Mg2+能与OH-结合生成沉淀,从而可除去Mg2+;
(3)碱性条件下Fe2+与空气中的氧气结合生成FeOOH,离子方程式为:4Fe2++O2+8OH-=4FeOOH↓+2H2O;
(4)向溶解的钛白渣中加入NH4HF2固体,除去了Mg2+,向过滤后的溶液中加入氢氧化钠溶液并通入空气,除去了铁元素,此时溶液中存在的阳离子是NH4+和Na+;
(5)根据温度与FeOOH产率的示意图可知40℃时FeOOH的产率最大,因此反应的适宜温度为40℃;由pH与FeOOH产率的示意图可知,当pH约4.5时FeOOH的产率最大,pH过低导致氧化铁黄部分溶于酸,pH过大导致Fe(OH)3增多。


科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
A.将纯水加热到95 ℃时,Kw变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小
C.向纯水中加入少量碳酸钠固体,影响水的电离平衡,c(H+)减小,Kw不变
D.向纯水中加入醋酸钠固体或盐酸,均可抑制水的电离,Kw不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的现象,与氧化还原反应无关的是
A | B | C | D | |
实验 | 酒精溶液滴入高锰酸钾溶液中 | 石蕊溶液滴入氯水中 |
| 常温下,铝片插入浓硫酸中 |
现象 | 高锰酸钾溶液褪色 | 溶液变红,随后迅速褪色 | 沉淀由黄色逐渐变为黑色 | 无明显现象 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类发现最早并广泛使用的一种金属。回答下列问题:
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的离子方程式为___。
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该反应的化学方程式___。配制FeCl3溶液和FeCl2溶液都应保持___(填“酸性”“碱性”或“中性”),原因是___。配制FeCl2溶液时还应加入少量铁屑,原因是___。
(3)溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I-=2CuI↓+I3- ②I3-+2S2O32-=3I-+S2O62-
反应①中的还原产物为___。现取10.00mL含Cu2+的溶液,加入足量KI充分反应后,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液12.50mL,此溶液中Cu2+的浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠![]() 是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出
是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出![]() ,
,![]() 有类似
有类似![]() 的性质。某兴趣小组探究亚氯酸钠的制备与性质。
的性质。某兴趣小组探究亚氯酸钠的制备与性质。
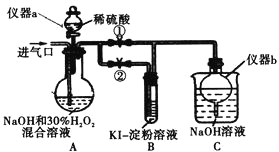
(I)制备亚氯酸钠
关闭止水夹![]() ,打开止水夹
,打开止水夹![]() ,从进气口通入足量
,从进气口通入足量![]() ,充分反应。
,充分反应。
(1)仪器a的名称为_________,仪器b的作用是_________。
(2)装置A中生成![]() 的化学方程式为_________。
的化学方程式为_________。
(3)若从装置A反应后的溶液中获得![]() 晶体,则主要操作有:减压蒸发浓缩、________、过滤、洗涤、干燥等。
晶体,则主要操作有:减压蒸发浓缩、________、过滤、洗涤、干燥等。
(II)探究亚氯酸钠的性质
停止通![]() 气体,再通入空气一段时间后,关闭止水夹
气体,再通入空气一段时间后,关闭止水夹![]() ,打开止水夹
,打开止水夹![]() ,向A中滴入稀硫酸。
,向A中滴入稀硫酸。
(4)请写出这时A中发生反应的离子方程式_________。
(5)开始时A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因_________。
(6)B中现象为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2![]() 在空气中存在下列平衡:2NO(g)+O2(g)
在空气中存在下列平衡:2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1,2SO2(g)+O2(g)
2NO2(g) ΔH=-113.0 kJ·mol-1,2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1。SO2通常在NO2的存在下,进一步被氧化生成SO3(g)。写出NO2和SO2反应生成NO(g)和SO3(g)的热化学方程式为________。
2SO3(g) ΔH=-196.6 kJ·mol-1。SO2通常在NO2的存在下,进一步被氧化生成SO3(g)。写出NO2和SO2反应生成NO(g)和SO3(g)的热化学方程式为________。
(2)提高2SO2(g)+O2(g)![]() 2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。
①温度为T℃时,在2 L的密闭容器中加入2.0 mol ![]() 和1.0 mol O2发生反应,达到平衡时容器内气体压强变为起始时的
和1.0 mol O2发生反应,达到平衡时容器内气体压强变为起始时的![]() 。该反应的平衡常数为_____。
。该反应的平衡常数为_____。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_____。
A.在其他条件不变时,减少容器的体积
B.在其他条件不变时,改用高效催化剂
C.在其他条件不变时,升高体系温度
D.1.0mol温度和容器体积不变,充入1.0 mol氦气![]()
E.温度和容器体积不变,充入1.0 mol O2
(3)利用如图所示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为______;若通入的NO体积为4.48 L(标况下),则理论上另一电极通入SO2的物质的量应为_______。
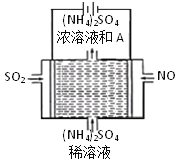
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
(1)常温下,将0.1mol/L HCl溶液与0.1 mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则MOH在水中的电离方程式为__________。
(2)已知常温时CH3COOH![]() CH3COO – + H+,Ka=2×10–5,则反应CH3COO – + H2O
CH3COO – + H+,Ka=2×10–5,则反应CH3COO – + H2O![]() CH3COOH + OH–的平衡常数Kh=______。
CH3COOH + OH–的平衡常数Kh=______。
(3)已知H2A在水中发生电离:H2A=H++HA–,HA–![]() H++A2–。
H++A2–。
① 等物质的量浓度的两种溶液:NaHA溶液的pH_____(填“>”、“=”或“<”)Na2A溶液的pH。
② 已知0.1 mol·L-1 NaHA溶液的pH=2,该溶液中各种离子浓度由大到小的顺序是______。
③某温度下,若向0.1 mol·L–1的NaHA溶液中逐滴滴加0.1 mol·L–1 NaOH溶液至溶液呈中性。对该混合溶液,下列说法一定正确的是____(填序号)。
A.c(H+)·c(OH–)=1×10–14 B.c(Na+)=c(HA–)+2c(A2–)
C.溶液中水的电离程度逐渐减小 D.c(Na+)=c(HA–)+c(A2–)
(4)常温下,若在0.10 mol·L–1 CuSO4溶液中加入NaOH稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________mol·L–1 {Ksp[Cu(OH)2]=2.2×10–20}。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
①由H2、I2蒸气、HI气体组成的平衡体系加压后颜色变深
②黄绿色的氯水光照后颜色变浅
③使用催化剂可加快SO2转化为SO3的速率
④在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
A.②③B.②④C.①③D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的反应热:
(1)CH3COOH(l) + 2O2(g) = 2CO2(g) + 2H2O(l) △ H1 = 870.3 kJ · mol1
(2)C(s) + O2(g) = CO2(g) △ H2 = 393.5 kJ · mol1
(3)H2(g) + O2(g) = H2O(l) △ H3 = 285.8 kJ · mol1
则下列反应的反应热为( )2C(s) + 2H2(g) + O2(g) = CH3COOH(l)
A.△ H =+ 488.3 kJ · mol1B.△ H = 244.15 kJ · mol1
C.△ H = 977.6 kJ · mol1D.△ H = 488.3 kJ · mol1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com