
 (1)将粉末形状大小相同的铁和铝分别与等浓度的稀盐酸反应产生气泡的速率铝>铁(填“<、>、=”).Al与盐酸反应的离子方程式是2Al+6H+=2Al3++3H2↑.
(1)将粉末形状大小相同的铁和铝分别与等浓度的稀盐酸反应产生气泡的速率铝>铁(填“<、>、=”).Al与盐酸反应的离子方程式是2Al+6H+=2Al3++3H2↑.分析 (1)铝比铁活泼,与盐酸反应剧烈,生成氯化铝和氢气;
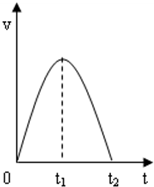
(2)0~t1时刻,该反应放热导致反应速率加快;t1~t2时氢离子浓度减小,反应速率减小;
(3)用铝与稀盐酸反应制取氢气时,增大氢离子的浓度、升高温度、增大接触面积等可加快反应速率,以此来解答.
解答 解:(1)铝比铁活泼,与盐酸反应剧烈,生成氯化铝和氢气,反应的离子方程式为:2Al+6H+=2Al3++3H2↑,
故答案为:>;2Al+6H+=2Al3++3H2↑;
(2)2Al+6H+=2Al3++3H2↑为放热反应,0~t1时刻反应放热溶液温度升高,速率增大;由于盐酸逐渐消耗,H+浓度减小,t1~t2段反应速率减小直到反应结束,
故答案为:反应放热溶液温度升高,速率增大;盐酸逐渐消耗,H+浓度减小,速率减小直到反应结束;
(3)①改成等浓度的稀硫酸,氢离子浓度增大,反应速率增大,
故答案为:增大;
②增大盐酸的体积,氢离子浓度不变,则反应速率不变,
故答案为:不变;
③稍稍加热盐酸,温度升高,反应速率增大,
故答案为:增大;
④加入少量固体NaCl,对氢离子浓度无影响,则反应速率不变,
故答案为:不变;
⑤再加入少量相同的Al粉,浓度不变,反应速率不变,
故答案为:不变;
⑥通入少量HCl气体,盐酸浓度增大,反应速率增大,
故答案为:增大.
点评 本题考查影响化学反应速率的因素,为高频考点,明确温度、浓度、催化剂对反应的影响即可解答,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | B可以从溶液中置换出C单质 | |
| B. | 简单离子半径:D>A>B>C | |
| C. | A和D形成的化合物溶于水可导电,所以该化合物为电解质 | |
| D. | 最高价氧化物对应的水化物的酸性:A>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z与Q形成化合物的电子式为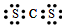 | |
| B. | X与Z、Q形成的化合物均为大气污染物 | |
| C. | Q与W能形成10电子、14电子、18电子分子 | |
| D. | Y、Z、Q分别与X只能组成化学式为AB2型化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点℃ | 沸点℃ | 密度 (g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500 | 1.984 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1+△H2=△H3 | B. | △H1-△H2=△H3 | C. | △H1+2△H2=△H3 | D. | △H1-2△H2=△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①④ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、NO3-、CO32- | B. | Fe3+、K+、I-、SCN | ||
| C. | Al3-、Cu2+、SO42-、NO3- | D. | NH4-、K+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com