
| A. | 温度升高,该反应反应速率加快,平衡常数增大 | |
| B. | 题目所述的某时刻正、逆反应速率的大小为V(正)>V(逆) | |
| C. | 经10min反应达到平衡,则该时间内反应速率v(A)为0.064mol/(L•min) | |
| D. | 平衡时,再加入与起始等量的A,达新平衡后A的转化率增大 |
分析 A.升温,速率加快;K只受温度影响;
B.用Qc与此温度下的平衡常数K来判断;
C.由题中数据可知A的起起始浓度为1.6amol/l,设平衡时,A的浓度为amol/l,根据K建立关系系计算,再用v=$\frac{△c}{△t}$计算;
D.平衡时,再加入与起始等量的A,达到新的平衡时,与一次性加入2倍的A属于等效平衡.
解答 解:A.升温,速率加快;该反应是放热反应,升温平衡向吸热方向移动,即逆方向移动,平衡常数K减小,故A错误;
B.此时Qc=$\frac{生成物浓度幂之积}{反应物浓度幂之积}$=$\frac{0.6×0.6}{0.{4}^{2}}$=2.25<K=4,则此时未达平衡,向正方向进行,正方向速率占优势,则V(正)>V(逆),故B正确;
C.由题中数据可知A的起起始浓度为1.6amol/l,设平衡时,A的浓度为amol/l,
2A(g)?B(g)+C(g)
起始浓度(mol/l):1.6 0 0
变化浓度(mol/l):1.6-a (1.6-a )/2 (1.6-a)/2
平衡浓度(mol/l):a (1.6-a )/2 (1.6-a )/2
根据K=$\frac{平衡时生成物浓度幂之积}{平衡时反应物浓度幂之积}$=$\frac{\frac{1.6-a}{2}×\frac{1.6-a}{2}}{{a}^{2}}$=4,解得a=0.32,则A变化浓度为(1.6-0.32)mol/l,所以v(A)=$\frac{△c}{△t}$=$\frac{(1.6-0.32)mol/L}{10min}$=0.128mol/L,故C错误;
D.平衡时,再加入与起始等量的A,达到新的平衡时,与一次性加入2倍的A属于等效平衡,在相同条件下,取2个相同的1L容器,分别加入等量的A,一段时间后,都达到化学平衡状态,这两个平衡完全等效,再压缩成1L,对于反应2A(g)?B(g)+C(g),前后体积不变,则平衡不移动,所以A的转化率不变,故D错误;
故选:B.
点评 本题考查较为综合,涉及化学平衡的移动,化学反应速率、平衡常数的计算,注意把握平衡常数的意义,建立等效平衡的思维解题可以培养学生的思维能力,题目有一定难度.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:多选题
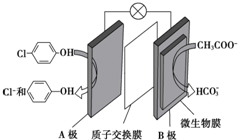 含乙酸钠和对氯酚(
含乙酸钠和对氯酚(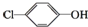 )的废水可以利用微生物电池除去,其原理如图所示,下列有关说法不正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示,下列有关说法不正确的是( )| A. | 电极B是负极 | |
| B. | 质子从A极移向B极 | |
| C. | B极的电极反应式:CH3COO--8e-+4H2O═2HCO3-+9H+ | |
| D. | 处理后的废水pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
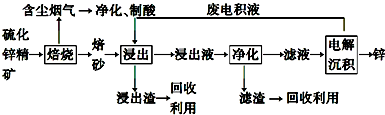
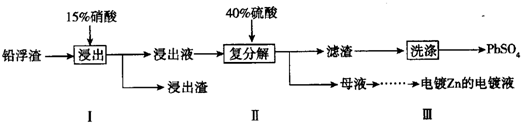
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
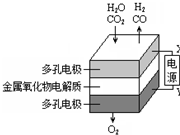 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法正确的是( )| A. | X是电源的正极 | |
| B. | 阳极的反应式是:4OH--4eˉ=2H2O+O2↑ | |
| C. | 总反应可表示为:H2O+CO2=H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNaCN中含共价键数为0.3NA | |
| B. | 0.1mol/LNaHCO3溶液中HCO3-的数目小于0.1NA | |
| C. | 19gH218O2含有的中子数为12NA | |
| D. | 上述反应中,当有22.4LNH3生成时,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
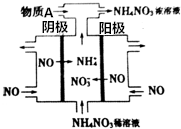 如图是利用N2H4-KOH-O2为电源点解NO制备NH4NO3,其工作原理如图所示:
如图是利用N2H4-KOH-O2为电源点解NO制备NH4NO3,其工作原理如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医用酒精是用淀粉类植物经过发酵后蒸馏制得,浓度通常是75% | |
| B. | 为防止电池中的重金属污染土壤和水体,应将废电池深埋 | |
| C. | “海水淡化”可以解決“淡水供应危机”,向海水中加入明矾可以使海水淡化 | |
| D. | 小苏打是制作面包等糕点的膨松剂.也是胃溃疡病人的治疗药物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
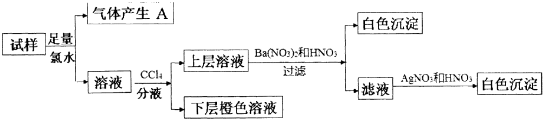
| A. | 气体A为CO2 | |
| B. | 无法确定原溶液中是否存在Cl- | |
| C. | 原无色溶液中至少存在四种离子 | |
| D. | 肯定不存在的离子是Mg2+、Cu2+、Al3+、NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com