
【题目】联合国宣布2019年为“国际化学元素周期表年”。短周期主族元素A、B、C、D、E的原子序数依次增大。A原子的最外层电子数是其内层电子数的2倍,B的单质是空气的最主要成分,C的单质在某些浓酸溶液中能发生钝化,D和A在同一主族,E的其中一种氧化物是造成酸雨的主要物质之一。请回答下列问题:
(1)A元素的名称为_________;元素E在周期表中的位置是________。
(2)A、B、D的原子半径的大小顺序是_________(用元素符号表示)。A和D的简单气态氢化物中稳定性较强的是___________(用化学式表示)。
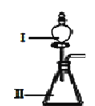
(3)B和D最高价氧化物对应的水化物中,酸性较强的是___________。若用如图中装置验证这两种酸的酸性强弱,则在装置Ⅱ中加入的试剂分别为__________,观察到的实验现象是__________。
(4)AE2常温下呈液态,则AE2的化学键类型是_______。已知AE2在氧气中完全燃烧,生成AO2和EO2,若 0.1 mol AE2在 1 mol O2中完全燃烧,所得混合气体在标准状况下的体积为________L。
(5)B的最高价氧化物对应的水化物的稀溶液与SO2反应的离子方程式为________
【答案】碳 第三周期第VIA族 Si>C>N CH4 HNO3 Na2SiO3 Ⅱ中产生白色沉淀 共价键 22.4L 3SO2 + 2NO3- + 2H2O = 3SO42- + 2NO↑ + 4H+
【解析】
A原子的最外层电子数是其内层电子数的2倍,A的内层为K层,K层填满有2个电子,则A的最外层有4个电子,A为C;B的单质是空气的最主要成分,则B为N;C的单质在某些浓酸溶液中能发生钝化,在短周期中Al遇浓硫酸、浓硝酸钝化,则C为Al;D和A在同一主族,D为Si;E的其中一种氧化物是造成酸雨的主要物质之一,结合原子序数,E为S。则A、B、C、D、E分别为C、N、Al、Si、S。
(1)A为C元素,其名称为碳;E为S元素,在周期表的位置是第三周期第ⅥA族;
(2)同周期元素原子从左到右依次减小,C>N;同主族元素原子从上到下依次增大,则Si>C;则A、B、D原子半径的大小半径是Si>C>N;同主族元素从上到下,非金属性减弱,非金属性越强,其气态氢化物的稳定性越强,则CH4的稳定性强;
(3)同主族元素非金属性从上到下依次减弱,同周期元素从左到右依次增强,可知非金属性N(B)>C>Si(D),非金属性越强,其最高价氧化物的水化物的酸性越强,则酸性较强的是HNO3;要证明HNO3的酸性强于H2SiO3,利用强酸制弱酸的方法,分液漏斗中盛装硝酸,锥形瓶中盛装Na2SiO3溶液,发生生成硅酸沉淀;可看到Ⅱ中产生白色沉淀;
(4)AE2为CS2,C达到稳定结构需要得到4个电子,S达到稳定结构需要得到2个电子,因此C和S通过共用达到稳定结构,CS2中含有共价键;CS2燃烧的化学方程式为CS2+3O2=CO2+2SO2,CS2是液体,该反应前后气体体积不变,因此0.1molCS2在1molO2中完全燃烧,所得混合气体的物质的量为1mol,其在标准状况下的体积为22.4L;
(5)B的最高价氧化物对应的水化物的稀溶液为稀硝酸;SO2具有还原性,HNO3具有氧化性,发生氧化还原反应,离子方程式为3SO2+2NO3-+2H2O=3SO42-+2NO↑+4H+。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】常温下,0.1mol·L-1 的 FeCl3 溶液呈___________性(填“酸”、“碱”或“中”),原因是___(请用离子方程式表示)。电子工业曾用 30%的 FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得到 FeCl3 溶液,设计如下实验流程:
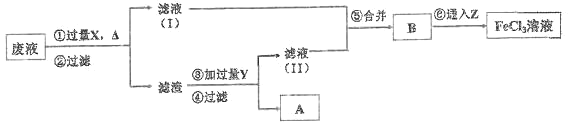
上述流程中,所加试剂的化学式为:X_____,Y_________,Z_____;第⑥步反应的离子方程 式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
A.![]() 标准状况
标准状况![]() 氦气含有的质子数为
氦气含有的质子数为![]()
B.1mol氯气与足量的铁反应,转移电子数目为3NA
C.![]() 溶液中所含
溶液中所含![]() 的数目为
的数目为![]()
D.密闭容器中![]() 与
与![]() 充分反应,产物的分子数为
充分反应,产物的分子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京奥运会祥云火炬的主要燃料为丙烷,下列关于丙烷的说法正确的是
A.丙烷分子中3个碳原子在一条直线上
B.丙烷可以与溴水发生取代反应
C.丙烷在空气中燃烧只可能生成CO2和H2O
D.常温常压下,22g丙烷所含氢原子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上消除氮氧化物的污染,可用如下反应:![]()
![]() 在温度
在温度![]() 和
和![]() 时,分别将
时,分别将![]() 和
和![]() 充入体积为1L的密闭容器中,测得
充入体积为1L的密闭容器中,测得![]() 随时间变化数据如下表:下列说法错误的是( )
随时间变化数据如下表:下列说法错误的是( )
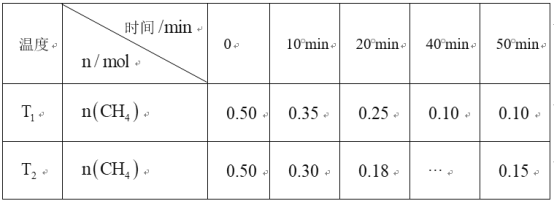
A.10min内,![]() 时
时![]() 的化学反应速率比
的化学反应速率比![]() 时小
时小
B.温度:![]()
C.![]()
D.平衡常数:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
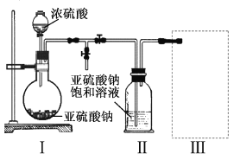
实验一焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:
Na2SO3+SO2=Na2S2O5
(1)装置I中产生气体的化学方程式为 。
(2)要从装置II中获得已析出的晶体,可采取的分离方法是 。
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 。(填序号)。
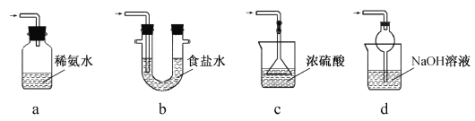
实验二焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)检验Na2S2O5晶体在空气中已被氧化的实验方案是 。
实验三葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:馏分中的二氧化硫在滴入碘水时发生的反应为
SO2+I2+2H2O=H2SO4+2HI)在测定时消耗了0.01mol·L-1的I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应![]() ,在容积固定的密闭容器中达到平衡状态的标志是( )
,在容积固定的密闭容器中达到平衡状态的标志是( )
①单位时间内生成![]() 的同时生成
的同时生成![]()
②单位时间内生成![]() 的同时生成
的同时生成![]()
③用![]() 表示的反应速率之比为
表示的反应速率之比为![]() 的状态
的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的物质的量不再改变的状态
A.①④⑥⑦B.②③⑤⑦C.①③④⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图装置制取(该反应放出热量)。制取时观察到锥形瓶中导管口有白雾出现等现象。下列说法错误的是
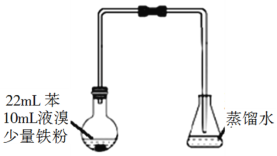
A. 制备溴苯的反应属于取代反应
B. 装置图中长直玻璃导管仅起导气作用
C. 该反应还可能看到烧瓶中有红色蒸汽
D. 溴苯中溶有少量的溴,可用NaOH溶液洗涤除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):
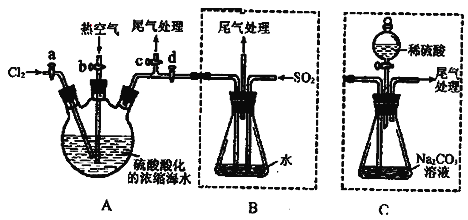
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入氯气至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO2;
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答:
(1)工业上采用电解饱和食盐水的方法来制备氯气,该反应的化学方程式为______________________________________________________________________;
(2)步骤②中鼓入热空气的作用为___________________________________;此实验中尾气可用_____(填选项字母)吸收处理。
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCl溶液
(3)步骤③中发生的主要反应的离子方程式为______________________________。
(4)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBr、NaBrO3等,该反应的化学方程式为___________________________________。
(5)与B装置相比,采用C装置的优点为________________,__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com