
某实验小组进行了如下图所示的实验。下列说法不正确的是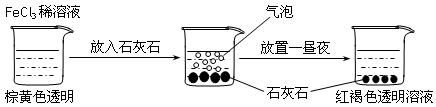
| A.红褐色液体为氢氧化铁胶体 | B.加入石灰石是为了促进氯化铁水解 |
| C.产生的气泡是HCl 气体 | D.产生的气泡是CO2气体 |
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
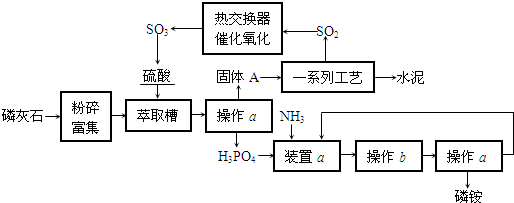
| ||
| ||
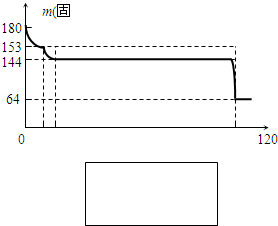
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验编号 | 实验操作 | 实验现象 |
| ① | 加入适量稀盐酸 | 有微量气泡,固体全部溶解,得到澄清溶液 |
| ② | 加入适量蒸馏水 | 固体部分溶解 |
| ③ | 加入适量无水乙醇 | 固体部分溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
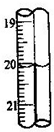 (2012?长宁区二模)三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(2012?长宁区二模)三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.05 | 21.04 |
| 2 | 25.00 | 1.50 | 24.50 |
| 3 | 25.00 | 0.20 | 20.21 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 滴定次数 | 待测溶液的体积(mL) | 标准溶液的体积 | |
| 初读数(mL) | 末读数(mL) | ||
| 1 | 10.00 | 0.00 | 14.90 |
| 2 | 10.00 | 0.10 | 15.05 |
| 3 | 10.00 | 0.50 | 17.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com