
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____________________(填字母)。
A.c(H+) B.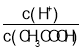 C.c(H+)c(OH﹣) D.
C.c(H+)c(OH﹣) D.![]() E.
E.![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:______________________。
(4)25℃时,将a mol/L的醋酸与等浓度的氢氧化钠等体积混合,反应后溶液中的离子浓度由大到小关系是______________________________。
【答案】a<d<c<b BD ClO-+H2O+CO2=HCO3-+HClO (Na+)>c(CH3COO-)>c(OH-)>c(H+)
【解析】
(1)Ka越小酸性越弱,且酸性越弱对应盐的水解程度越大,盐溶液的pH越大;
(2)A.加水促进电离,但氢离子浓度减小;
B.加水稀释促进醋酸电离,氢离子的物质的量增大,醋酸的物质的量减小;
C.温度不变,Kw不变;
D.加水稀释促进醋酸电离,但溶液中氢离子浓度减小,温度不变,水的离子积常数不变,氢氧根离子浓度增大;
E.温度不变,电离平衡常数不变;
(3)发生强酸制取弱酸的反应;
(4)a mol/L的醋酸与等浓度的氢氧化钠等体积混合后得到CH3COONa溶液,CH3COO-水解,溶液呈碱性。
(1)相同条件下,酸的电离平衡常数越小,则酸的电离程度越小,酸根离子水解程度越大,则相同浓度的钠盐,其pH值越大,根据电离平衡常数知,酸根离子水解程度大小顺序是:CO32->ClO->HCO3->CH3COO-,则等浓度的盐溶液的pH大小顺序是a<d<c<b;
(2)A.加水稀释促进醋酸电离,但溶液中c(H+)减小,故A错误;
B.加水稀释促进醋酸电离,氢离子的物质的量增大,醋酸的物质的量减小,则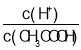 增大,故B正确;
增大,故B正确;
C.温度不变,则Kw=c(H+)c(OH-)不变,故C错误;
D.加水稀释促进醋酸电离,但溶液中氢离子浓度减小,温度不变,水的离子积常数不变,氢氧根离子浓度增大,所以![]() 增大,故D正确;
增大,故D正确;
E.温度不变,电离平衡常数不变,则Ka=![]() 不变,E故错误;
不变,E故错误;
故答案为:BD;
(3)根据电离平衡常数的数据,可知次氯酸的酸性强于碳酸氢根离子,所以向次氯酸钠溶液中通入少量或过量二氧化碳,都生成碳酸氢根离子和次氯酸,不能生成碳酸根离子和次氯酸,故离子方程式为ClO-+H2O+CO2=HCO3-+HClO;
(4)a mol/L的醋酸与等浓度的氢氧化钠等体积混合后得到CH3COONa溶液,CH3COO-水解,溶液呈碱性,则c(OH-)>c(H+),此时溶液中存在电荷守恒式c(CH3COO-)+ c(OH-)= c(H+)+ c(Na+),则c(Na+)>c(CH3COO-),故溶液中的离子浓度由大到小关系是c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。


科目:高中化学 来源: 题型:
【题目】已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=8.0×10-38,Kb(NH3·H2O)=1.8×10-5,下列叙述中不正确的是
A.25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀
B.25℃时,MgCl2溶液中有少量FeCl3时,可以加入MgO进行除杂
C.25℃时,加大量水稀释氨水,电离程度增大,溶液导电能力增强
D.25℃时,![]() +H2O
+H2O![]() NH3·H2O+H+的平衡常数为5.6×10-10
NH3·H2O+H+的平衡常数为5.6×10-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量的水后,产生1.16g白色沉淀。再向所得悬浊液中逐滴加入1.00mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。试回答:

(1)写出A点到B点发生反应的离子方程式
(2)C点加入盐酸溶液的体积为 。
(3)原混合物中MgCl2的物质的量是 ,NaOH的质量是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.3 molMnO2和100mL 12 mol/L的浓盐酸混合后缓慢加热,充分反应后向剩余的溶液中加入足量的AgNO3溶液,生成AgCl沉淀的物质的量为(不考虑HCl的挥发)( )
A.等于0.6molB.小于0.6mol
C.大于0.6mol,小于1.2molD.等于1.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述正确的是
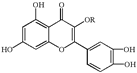
A.分子中的官能团有羟基、碳碳双键、醚键、酯基
B.若R为乙基则该物质的分子式可以表示为![]()
C.lmol该化合物最多可与![]() 完全反应
完全反应
D.lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,某FeCl3溶液的pH=2,则由水电离产生的总c(OH-)=____________;用离子方程式表示FeCl3溶液用于净水的原因____________________________________。
(2)已知NaHSO4在水中的电离方程式NaHSO4=Na++H++SO42-。在NaHSO4溶液中c(H+)___________c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH__________7。
(3)将0.02mol/LNa2SO4溶液与某浓度BaCl2溶液等体积混合,则生成BaSO4沉淀所需原BaCl2溶液的最小浓度为_________________________________。(已知Ksp(BaSO4)=1.1×10-10)
(4)一定温度下,测得某纯水的pH为6.5。此时水的离子积常数Kw为_______;若在此纯水中加一定量Ba(OH)2固体,配制成0.005mol·L-1的Ba(OH)2溶液,保持原温度,其溶液的pH为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取氯化铁粉末所需装置如下,已知氯化铁粉末很容易吸水生成结晶化合物:FeCl3+6H2O=FeCl3·6H2O。
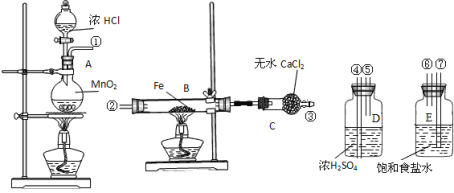
(1)按照气体流向从左到右顺序连接仪器应是①接_____,____接______,____接_______。
(2)烧瓶A中发生的反应_________________,B中反应的现象是____________。
(3)容器D的作用是_______,容器E的作用是_________。
(4)实验时应先点燃__处(填“A”或“B”)的酒精灯,理由是___________________________。
(5)这套实验装置是否完整?___(填“是”或“否”),若不完整,还须补充___________装置(若第一问填“是”,则此问不需要作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,氯水中部分含氯微粒的物质的量浓度随pH的变化趋势如图所示。下列叙述正确的是
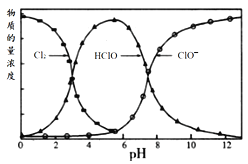
A.pH=1的新制氯水中,c(Cl2)>c(HClO)>c(ClO-)
B.随着pH增大,溶液的颜色加深
C.当pH=10时,溶液中的含氯微粒只有ClO-
D.向pH=4的氯水中加入NaOH溶液,只发生化学反应:HClO+NaOH=NaClO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.标准状况下,22.4 L水中所含的分子数约为6.02×1023个
B.1 mol Cl2中含有的原子数为NA
C.标准状况下,aL氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023个
×6.02×1023个
D.常温常压下,11.2 L CO分子数是0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com