
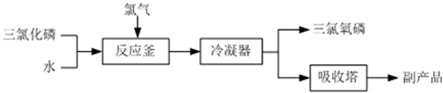
分析 ①当滴定达到终点时NH4SCN过量,Fe3+与SCN-反应溶液变红色,半分钟内不褪色,即可确定滴定终点;
②由于AgSCN沉淀的溶解度比AgCl小,可加入硝基苯用力摇动,使AgCl沉淀表面被有机物覆盖,避免在滴加NH4SCN时,将AgCl沉淀转化为AgSCN沉淀;若无此操作,NH4SCN标准液用量偏多.
解答 解:①用c mol•L-1NH4SCN溶液滴定过量Ag+至终点,当滴定达到终点时NH4SCN过量,加NH4Fe(SO4)2作指示剂,Fe3+与SCN-反应溶液会变红色,半分钟内不褪色,即可确定滴定终点;
故答案为:b;溶液变为红色,而且半分钟内不褪色;
②已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12,则AgSCN沉淀的溶解度比AgCl小,可加入硝基苯用力摇动,使AgCl沉淀表面被有机物覆盖,避免在滴加NH4SCN时,将AgCl沉淀转化为AgSCN沉淀;若无此操作,NH4SCN与AgCl反应生成AgSCN沉淀,则滴定时消耗的NH4SCN标准液的体积偏多,即银离子的物质的量偏大,则与氯离子反应的银离子的物质的量偏小,所以测得的氯离子的物质的量偏小;
故答案为:防止在滴加NH4SCN时,将AgCl沉淀转化为AgSCN沉淀;偏小.
点评 本题考查了物质的制备方案设计,题目涉及滴定原理以及难溶电解质的溶度积常数的应用等,题目综合性较强,难度中等,侧重于考查学生的分析能力和对基础知识的综合应用能力.


科目:高中化学 来源: 题型:选择题
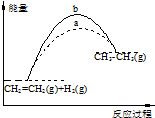
| A. | 图1中a、b曲线可分别表示反应CH2═CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时反应过程中的能量变化 | |
| B. | 己知2C(s)+2O2(g)═2CO2(g)△H1 ,2C(s)+O2(g)═2CO(g)△H2则△H1>△H2 | |
| C. | 同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| D. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.4 kJ•mo1-1,20g氢氧化钠固体溶于稀盐酸中恰好完全反应时放出的热量等于28.7kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4•5H2O | B. | CuSO4 | C. | Cu(OH)2•6H2O | D. | Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com