
| A. | Mg2+、NO3-、SO42-、Na+ | B. | K+、SO42-、HCO3-、Na+ | ||
| C. | NH4+、NO3-、Al3+、CH3COO- | D. | MnO4-、K+、SO42-、Na+ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
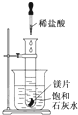 如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2mL的稀盐酸.下列对烧杯中的实验现象的描述及原因说明中正确的是( )
如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2mL的稀盐酸.下列对烧杯中的实验现象的描述及原因说明中正确的是( )| A. | 烧杯中出现白色浑浊,原因是试管中的反应放出热量使烧杯中饱 和石灰水温度升高,溶质析出 | |
| B. | 烧杯中出现白色浑浊,原因是试管中的反应吸收热量使烧杯中饱和石灰水温度降低,溶质析出 | |
| C. | 烧杯中没有任何现象,原因是试管中的反应与烧杯中饱和石灰水没有关系 | |
| D. | 烧杯中没有任何现象,原因是试管中的反应既不放出热量,也不吸收热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每生成1molO2,有44gCO2被还原 | |
| D. | a电极的反应为:3CO2+18H++18e-=C3H8O+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
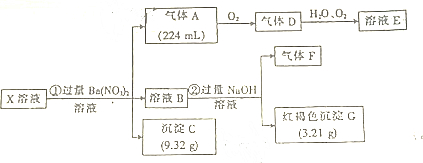
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=b,pH(NaX)>pH(NaY),则酸性:HX>HY | |
| B. | 若a=b,并测得c(X-)=c(HY)+c(Y-),则HX是强酸 | |
| C. | 若a>b,c(X-)=c(Y-),可推出酸性:HX>HY | |
| D. | 若两溶液等体积混合,测得c(X-)+c(HX)+c(HY)+c(Y-)=0.1mol•L-1,则可求得a=b=0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
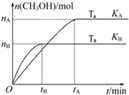 一定条件下,在容积为3L的密闭容器中加入1molCO和2molH2发生反应:CO(g)+2H2(g)?CH3OH(g)△H,达平衡状态.根据图示回答:
一定条件下,在容积为3L的密闭容器中加入1molCO和2molH2发生反应:CO(g)+2H2(g)?CH3OH(g)△H,达平衡状态.根据图示回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com