
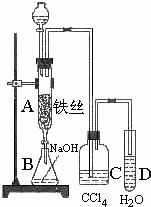
 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.| Fe |
| Fe |


科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、CO的燃烧热为283 kJ/mol |
| B、二氧化碳分解为一氧化碳和氧气的反应是吸热反应 |
| C、△H3=△H2-△H1=110.5 kJ/mol |
| D、△H3=△H1-△H2=-110.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
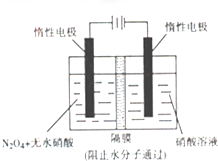
查看答案和解析>>
科目:高中化学 来源: 题型:
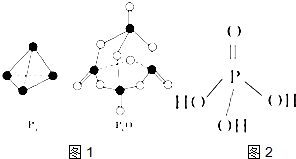 第五主族的磷单质及其化合物在工业上有广泛应用.
第五主族的磷单质及其化合物在工业上有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若用标准状况下4.48LCH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ |
| B、由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H<-574 kJ?mol-1 |
| C、反应①②转移的电子数不同 |
| D、反应①②均为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
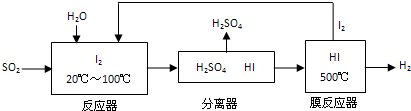
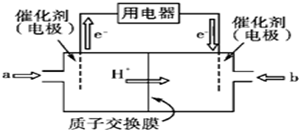
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com