
【题目】某化学小组用如图所示装置验证卤素单质氧化性的相对强弱.下列说法不正确的是
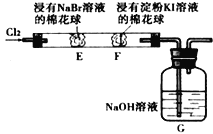
A. E处棉花球变成橙黄色,说明Cl2的氧化性比Br2强
B. F处棉花球变成蓝色,说明Br2的氧化性比I2强
C. E处发生反应的离子方程式为:Cl2 + 2Br- = 2Cl- + Br2
D. G装置中NaOH溶液与Cl2反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O
科目:高中化学 来源: 题型:
【题目】石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯与综合利用工艺如下:
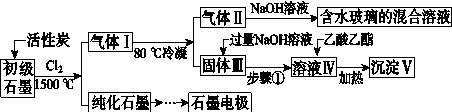
(注:SiCl4的沸点为57.6 ℃,金属氯化物的沸点均高于150 ℃)
(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是 。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物。气体Ⅰ中的碳氧化物主要为 。由气体Ⅱ中某物得到水玻璃的化学反应方程式为 。
(3)步骤①为:搅拌、 。所得溶液Ⅳ中的阴离子有 。
(4)由溶液Ⅳ生成沉淀Ⅴ的总反应的离子方程式为 ,
100kg初级石墨最多可能获得Ⅴ的质量为 kg。
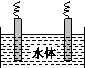
(5)石墨可用于自然水体中铜件的电化学防腐,完成如图防腐示意图,并作相应标注。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合氯化铝晶体是介于AlCl3和A1(OH)3之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产工艺流程如下:

(1)反应中副产品a是______(用化学式表示);
(2)升高pH至4.0~4.5的目的是______;
(3)生产过程中可循环使用的物质是______(用化学式表示);
(4)为使得到的晶体较纯净,生产过程中使pH升高的C物质可选用______(填编号);
a.NaOHb.Alc.氨水d.A12O3e.NaAlO2
(5)聚合氯化铝晶体的化学式可表示为[A12(OH)nCl6-nH2O]m,实验室为测定n的值,进行如下操作:
①称取ag晶体,制成粉末,加热至质量不再变化时,得到bg。此过程可能用到的下列仪器有______;
a.蒸发皿 b.坩埚 c.研钵 d.试管
②另取ag晶体:用A试剂溶解→加足量AgNO3溶液→进行C操作→洗涤、烘干→称量为cg。则试剂A为______(填操作名称),C操作为______(填操作名称)。最后综合推算出n的值_____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图1所示,A中放有浓硫酸,B中放有无水乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl26C2H5OH。
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
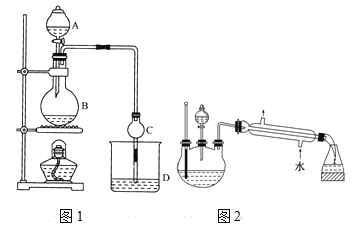
请回答:
(1)浓硫酸的作用是____;用同位素18O示踪法确定反应产物水分子中氧原子的提供者,若用18O标记乙醇分子中的氧原子,请写出该化学方程式:________。
(2)球形干燥管C的作用是_______。若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是_______。
(3)采用分液法从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,然后加入无水氯化钙,分离出________;再加入无水硫酸钠除去水,然后进行________(填操作名称),以得较纯净的乙酸乙酯。
(4)上述实验中饱和碳酸钠溶液的作用是______(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(5)另一化学课外小组对上述实验进行了改进,设计了图2所示的装置,利用浓硫酸、乙醇、乙酸制取乙酸乙酯(铁架台、铁夹、加热装置均已略去)与图1所示装置相比,此装置的主要优点有(写出一条即可)________。
(6)该实验中用30g乙酸与46g乙醇反应,如果实际得到的乙酸乙酯的质量是26.4g,则该实验中乙酸乙酯的产率是______。(产率指的是某种生成物的实际产量与理论产量的比值。已知乙醇、乙酸、乙酸乙酯的相对分子质量分别为:46、60、88)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
实验方案 |
|
|
|
|
目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由Fe2+变为Fe3+若榨汁时加入维生素C,可有效防止这种现象的发生这说明维生素C具有()
A.还原性B.氧化性C.碱性D.酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下,下列说法不正确的是

A. NH4ClO4属于离子化合物
B. 溶解度: NaClO4> NH4ClO4
C. 电解NaClO3溶液时阳极反应式为ClO3—+H2O-2e-===C1O4—+2H+
D. 该流程中可循环利用的物质是NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质Ⅲ(2,3—二氢苯并呋喃)是一种重要的精细化工原料,其合成的部分流程如下:

下列叙述正确的是
A. 可用溴水可以鉴别化合物Ⅰ和Ⅱ
B. 物质Ⅰ在NaOH醇溶液中加热可发生消去反应
C. 物质Ⅱ中所有原子可能位于同一平面内
D. 物质Ⅲ与足量H2加成所得产物分子中有2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl![]() 和AlCl
和AlCl![]() 组成的离子液体作电解液时,可在钢制品上电镀铝。
组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为________________________________。若改用AlCl3水溶液作电解液,则阴极产物为________。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________。
a.KCl b.KClO3c.MnO2d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,理由是___________________(用离子方程式说明)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com