
【题目】短周期主族元素R、X、Y、Z 在周期表中的相对位置如图所示。已知: Y的最高价氧化物对应的水化物既能与强碱反应,又能与强酸反应。下列说法不正确的是
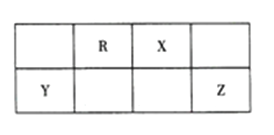
A. 简单气态氢化物的热稳定性: R<X
B. Y、Z的简单离子在同一溶液中能大量共存
C. 工业上,采用电解法冶炼单质Y
D. RZ2是含极性键的共价化合物
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】硅是一种重要的非金属单质,硅及其化合物的用途非常广泛。根据所学知识回答硅及其化合物的相关问题。
(1)硅的最高价氧化物对应水化物化学式可能是_____。
A.H4SiO3 B.H2SiO3 C.H3SiO4 D.HSiO4
(2)金刚石与金刚砂(SiC)具有相似的晶体结构,在金刚砂的空间网状结构中,碳原子、硅原子交替以共价 单键相结合。金刚砂属于_____晶体。金刚砂的熔点比金刚石的熔点_____;金刚砂的结构中,一个硅原子周围结合_____个碳原子。
(3)晶体硅的微观结构与金刚石相似,晶体硅中 Si—Si 键之间的夹角大小约为_____。 下表列有三种物质(晶体)的熔点:
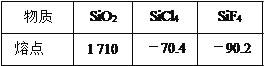
简要解释熔点产生差异的原因:
①SiO2 和 SiCl4:_________________________;
②SiCl4和 SiF4:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用H++OH-=H2O表示的是( )
A.NaOH溶液和H2CO3的反应B.氨水和稀H2SO4的反应
C.Ba(OH)2溶液和稀H2SO4的反应D.KOH溶液和盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中进行如下反应:N2+3H2![]() 2NH3,5min内氨的物质的量质量增加了0.1mol,则反应速率为
2NH3,5min内氨的物质的量质量增加了0.1mol,则反应速率为
A. v(NH3)=0.02mol/(L·min)
B. v(NH3)=0.01mol/(L·min)
C. v(N2)=0.01mol/(L·min)
D. v(H2)=0.03mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)下图能正确表示该反应中能量变化的是________。
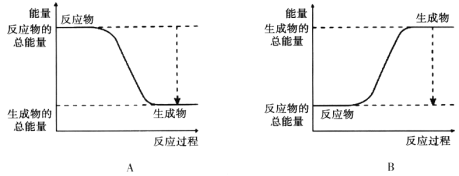
(3)从断键和成键的角度分析上述反应中能量的变化。
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
请填写下表:
化学键 | 填“吸收热量”或“放出热量” | 能量变化(kJ) | |
拆开化学键 | 2molH2化学键 | ________ | ________ |
1molO2化学键 | |||
形成化学键 | 4molH-O键 | ________ | ________ |
总能量变化 | ________ | ________ | |
(4)氢氧燃料电池的总反应方程式为2H2 +O2=2H2O。其中,氢气在______极发生_______反应。电路中每转移0.2mol电子,标准状况下消耗H2的体积是______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图Ⅱ表示常温下,0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000mol·L-1 CH3COOH溶液所得到的滴定曲线
C. 图Ⅲ表示一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化曲线,图中a、b、c三点醋酸的电离程度:a<b<c
D. 图Ⅳ表示反应4CO(g)+2NO2(g ) ![]() N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有H2RO4=H++HRO4-、HRO4-![]() H++RO42-,现有物质的量浓度都为0.1mol/L的三种溶液:①NaHRO4溶液; ②H2RO4溶液; ③Na2RO4溶液。下列说法正确的是
H++RO42-,现有物质的量浓度都为0.1mol/L的三种溶液:①NaHRO4溶液; ②H2RO4溶液; ③Na2RO4溶液。下列说法正确的是
A. ②和③等体积混合后的溶液中: c( Na+)= c( HRO4-)+c(H2RO4) +c(RO42-)
B. 100mL①溶液中: n(HRO4-)+n(RO42-)+n(OH-)-n(H+)= 0.01
C. ①和②等体积混合后的溶液中可能的离子浓度为c( HRO4-)>c(H+)>c(Na+)
D. 若①和③等体积混合后,会抑制水的电离,则HRO4-的电离程度肯定大于RO42-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为一类物质,下列分类标准不正确的是( )
A.钠的化合物
B.可与硝酸反应
C.可溶于水
D.电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组均为两种化合物溶于水时电离出的离子,其中由酸电离的是( )
A.Na+、OH﹣、SO42﹣
B.H+、Cl﹣、SO42﹣
C.Na+、K+、OH﹣
D.Na+、K+、NO3﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com