
| 实验 序号 | 滴加试剂 | 0.1mol•L-1FeCl23mL | 0.1mol•L-1 FeCl3 mL |
| 1 | 滴入2滴KSCN溶液 | 溶液颜色无明显变化 | 溶液变为红色 |
| 2 | 滴入2滴苯酚溶液 | 溶液颜色无明显变化 | 溶液变为紫色 |
| 3 | 滴入2滴酸性的KMnO4溶液 | 溶液先变紫红后褪色 | 溶液变紫红色 |
| 4 | 滴入NaOH溶液 | 出现红棕色沉淀 |
| 试剂 | KSCN溶液3滴 | 苯酚溶液2滴 | 0.01mol•L-KMnO4溶液3滴 | 10%NaOH溶液10滴 |
| 0.1mol•L-1FeCl3 | 深红色 | 紫色 | 黄色 | 红褐色沉淀 |
| 0.1mol•L-1FeCl2 | 无色 | 无色 | 无色 | 灰绿色沉淀 |
| 0.01mol•L-1FeCl3 | 红棕色 | 无色 | 几乎无色 | 淡黄色 |
| 0.01mol•L-1FeCl2 | 无色 | 无色 | 无色 | 无色 |
| 0.001mol•L-1FeCl3 | 无色 | 无色 | 无色 | 无色 |
| 0.001mol•L-1FeCl2 | 无色 | 无色 | 无色 | 无色 |
分析 (1)实验序号1、亚铁离子与KSCN不反应,铁离子和KSCN反应显血红色,实验序号2、苯酚与亚铁离子不反应,苯酚与铁离子反应显紫色,实验序号3、酸性的KMnO4溶液与亚铁离子发生氧化还原反应溶液先变紫红后褪色,酸性的KMnO4溶液与铁离子不反应,溶液变紫红色为酸性的KMnO4溶液颜色,实验序号4、氯化亚铁溶液滴入NaOH溶液,先生成白色沉淀,一会儿变成灰绿色,最后成红褐色沉淀,氯化铁溶液滴入NaOH溶液生成红棕色氢氧化铁沉淀;
(2)①根据上表信息,发现作为鉴别试剂的四种溶液在铁离子和亚离子中现象不同可鉴别;
②根据亚铁离子、铁离子本身颜色进行鉴别;
(3)碘单质与淀粉作用显蓝色,碘离子具有还原性,易被氧化剂氧化,铁离子能氧化碘离子,但空气中的氧气也能氧化碘离子;
(4)通过煮沸,蒸发溶剂,提高溶质的浓度来鉴别铁离子、亚铁离子,在加热过程中Fe2+极易被空气中的氧气氧化为Fe3+,无法鉴别.
解答 解:(1)实验序号1、亚铁离子与KSCN不反应,铁离子结合硫氰酸根离子形成血红色溶液,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3,实验序号2、苯酚与亚铁离子不反应,苯酚与铁离子反应C6H5OH+Fe3+?[Fe(C6H5O)6]3-+6H+显紫色,实验序号3、酸性的KMnO4溶液与亚铁离子发生氧化还原反应,MnO4-+8H++5Fe2+=5Fe3++Mn2++4H2O,Fe2+具有还原性,MnO4-被还原生成了无色的Mn2+,溶液先变紫红后褪色,酸性的KMnO4溶液与铁离子不反应,溶液变紫红色为酸性的KMnO4溶液颜色,实验序号4、氯化亚铁溶液中加入NaOH溶液后,发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,会过程中到:先生成白色沉淀,白色沉淀迅速经灰绿色并转化为红褐色沉淀,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,氯化铁溶液滴入NaOH溶液,氢氧化钠和氯化铁反应生成氢氧化铁和氯化钠,反应的化学方程式为:3NaOH+FeCl3═Fe(OH)3↓+3NaCl,生成红棕色氢氧化铁沉淀,
故答案为:MnO4-+8H++5Fe2+=5Fe3++Mn2++4H2O,Fe2+具有还原性,MnO4-被还原生成了无色的Mn2+;先生成白色沉淀,一会儿变成灰绿色,最后成红褐色沉淀,
(2)①根据上表信息可知:作为鉴别试剂的四种溶液在铁离子和亚离子中现象不同可鉴别,当浓度为0.1mol•L-1,上述四种溶液分别在铁离子、亚铁离子中现象都不同,可以鉴别Fe2+、Fe3+,当浓度为0.01mol•L-1,只能用KSCN溶液、10%NaOH溶液来鉴别Fe2+、Fe3+,由此可得:离子浓度不同,鉴别试剂的选择也不同,
故答案为:当浓度为0.1mol•L-1,上述四种溶液可以鉴别Fe2+、Fe3+、当浓度为0.01mol•L-1,只能用KSCN溶液、10%NaOH溶液来鉴别Fe2+、Fe3+;离子浓度不同,鉴别试剂的选择也不同;
②Fe2+溶液为绿色,Fe3+溶液为黄色,根据亚铁离子、铁离子本身颜色进行鉴别,观察两种溶液的颜色,0.1mol•L-1Fe2+溶液为绿色,0.1mol•L-1Fe3+溶液为黄色,
故答案为:观察两种溶液的颜色,0.1mol•L-1Fe2+溶液为绿色,0.1mol•L-1Fe3+溶液为黄色;
(3)碘单质与淀粉作用显蓝色,碘离子具有还原性,易被氧化剂氧化,铁离子能氧化碘离子,操作方法为:取两片KI淀粉试纸放在表面皿上,用玻璃棒蘸取两种溶液滴在试纸中间,若试纸变蓝色为0.1mol•L-1Fe3+,但空气中的氧气也能氧化碘离子,KI溶液易被空气中的氧气氧化,生成I2,也使试纸变蓝,实验失败,
故答案为:取两片KI淀粉试纸放在表面皿上,用玻璃棒蘸取两种溶液滴在试纸中间,若试纸变蓝色为0.1mol•L-1Fe3+;KI溶液易被空气中的氧气氧化,生成I2,也使试纸变蓝;
(4)Fe2+极易被空气中的氧气氧化为Fe3+,通过煮沸,蒸发溶剂,提高溶质的浓度来鉴别铁离子、亚铁离子,在加热过程中Fe2+极易被空气中的氧气氧化为Fe3+,无法鉴别,
故答案为:不行;在加热过程中Fe2+极易被空气中的氧气氧化为Fe3+.
点评 本题考查了探究Fe2+与Fe3+性质实验,注意掌握亚铁离子、铁离子的检验、氢氧化铁和氢氧化亚铁的性质,侧重学生分析能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
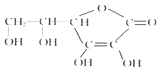 维生素C的结构简式如图所示:
维生素C的结构简式如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
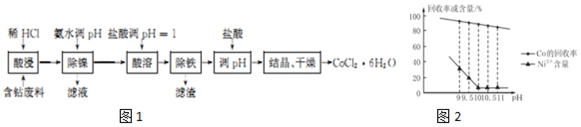
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.5 | 4.1 |
| Fe2+ | 7.5 | 9.7 |
| Co2+ | 6.6 | 9.4 |
| Ni2+ | 6.7 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 | |
| B. | 在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是Cu | |
| C. | 能与酸反应生成盐和水的氧化物一定是碱性氧化物 | |
| D. | 将Ba(OH)2溶液滴到明矾溶液中,当SO42-刚沉淀完时,铝以AlO2-的形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 瓜皮果壳-可回收垃圾 | B. | 医疗垃圾-危险废物 | ||
| C. | 玻璃制品-不可回收垃圾 | D. | 塑料-不可回收垃圾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com