
科目:高中化学 来源: 题型:
| 性质 元素 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
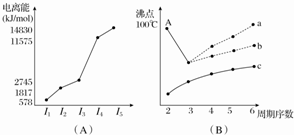
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、维生素C具有还原性,可作抗氧化剂 |
| B、油脂既能为人体提供热量,又能提供人体必需脂肪酸 |
| C、棉花、羊毛及合成纤维完全燃烧都只生成二氧化碳和水 |
| D、蛋白质遇饱和硫酸铵溶液产生的沉淀能重新溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com