
【题目】多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,遇水能强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子),制备BaCl2·2H2O,工艺流程如下:
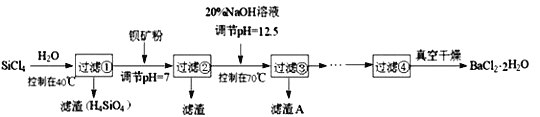
已知:
① 常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4;
② BaCO3的相对分子质量是197;BaCl2·2H2O的相对分子质量是244。
回答下列问题:
(1)SiCl4发生水解反应的化学方程式为______________________________________________
(2)用H2还原SiCl4蒸气可制取纯度很高的硅,当反应中有1 mol电子转移时吸收59 kJ热量,则该反应的热化学方程式为__________________________________________________________
(3)加钡矿粉并调节pH=7的目的是①______________________,②______________________
(4)过滤②后的滤液中Fe3+浓度为_______________(滤液温度25℃,Ksp[Fe(OH)3]=2.2×10-38)。
(5)生成滤渣A的离子方程式________________________________________
(6)BaCl2滤液经___________、__________、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O
【答案】SiCl4+4H2O==H4SiO4↓+4HCl SiCl4(g)+2H2(g)==Si(s)+4HCl(g) ΔH=+236 kJ·mol-1 使BaCO3转化为BaCl2 使Fe3+完全沉淀 2.2×10-17mol·L-1 Mg2++2OH-====Mg(OH)2↓ 蒸发浓缩 冷却结晶
【解析】
根据工艺流程图分析每步操作发生的反应;根据Ksp的表达式计算溶液中的离子浓度。
(1)SiCl4发生水解反应生成难溶的原硅酸,化学方程式为:SiCl4+4H2O=H4SiO4↓+4HCl;
故答案为:SiCl4+4H2O=H4SiO4↓+4HCl;
(2)1molSiCl4被还原成Si时转移4mol电子,所以吸收的热量为:59 kJ×4=236 kJ,所以热化学方程式为:SiCl4(s)+2H2(g)=Si(s)+4HCl(g) △H=+236kJ/mol;
故答案为:SiCl4(s)+2H2(g)=Si(s)+4HCl(g) △H=+236kJ/mol;
(3)钡矿粉的主要成分是BaCO3,滤液呈酸性,反应生成氯化钡,根据题干信息可知pH=7时,Fe3+完全沉淀;
故答案为:使BaCO3转化为BaCl2;使Fe3+完全沉淀;
(4) pH=7时,c(OH-)=10-7mol/L,Ksp[Fe(OH)3]= c3(OH-) c(Fe3+)=2.2×10-38,则c(Fe3+)=2.2×10-17mol·L-1;
故答案为:2.2×10-17mol·L-1;
(5)由流程图知当pH=12.5时,Mg2+完全沉淀,所以滤渣A是Mg(OH)2,反应方程式为:Mg2++2OH-=Mg(OH)2↓;
故答案为:Mg2++2OH-=Mg(OH)2↓;
(6)BaCl2滤液经蒸发浓缩,冷却结晶,过滤,洗涤再真空干燥后得到BaCl2.2H2O;
故答案为:蒸发浓缩、冷却结晶。


科目:高中化学 来源: 题型:
【题目】常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A. 1∶9 B. 1∶1 C. 1∶2 D. 1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PET是一种聚酯纤维,拉伸强度高,透光性好,广泛用作手机贴膜,合成如下:

下列关于该高分子的说法不正确的是
A. 合成PET的反应为缩聚反应
B. PET与聚乙二酸乙二酯具有相同的重复结构单元
C. PET膜应避免与碱性物质(如NaOH)长期接触
D. 通过质谱法测定PET的平均相对分子质量,可得其聚合度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化热是指一定条件下,lmol不饱和化合物加氢时放出的热量。表中是环己烯(![]() ),环己二烯(
),环己二烯(![]() )和苯的氢化热数据:
)和苯的氢化热数据:
物质 |
|
|
|
氢化热(kJ·mol-1) | ﹣119.7 | ﹣232.7 | ﹣208.4 |
根据表中数据推断正确的是( )
A.环己烯、环己二烯和苯分别跟氢气反应,环己二烯跟氢气反应最剧烈
B.环己烯、环己二烯和苯都含有相同的官能团
C.环己烯、环己二烯和苯相比较,苯最稳定
D.上述条件下,lmol![]() 转变为
转变为![]() 时吸收热量
时吸收热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】斑蝥素具有良好的抗肿瘤活性。下列反应是一个合成斑蝥素的路线:

(1)化合物A中含氧官能团的名称为___、___。
(2)B→C的反应类型是___。
(3)D与乙二醇发生缩聚反应的方程式为:___。
(4)物质X的结构简式为___。
(5)请写出以![]() 为原料制备
为原料制备 的合成路线流程图___(无机试剂可任用,合成路线流程图见本题题干)。
的合成路线流程图___(无机试剂可任用,合成路线流程图见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,实验是进行科学探究的重要方式,认识常见的化学实验仪器是学生必备的学科素养之一。写出题中指定的化学实验仪器的名称。

A.________B.________C.________D.________E.________F.________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图转化关系(其他产物已略去),下列说法错误的是( )
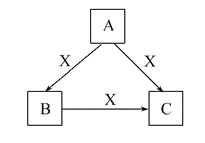
A. 若X为Cl2,则C可能为FeCl3
B. 若X为KOH溶液,则A可能为AlCl3
C. 若X为O2,则A可能为硫化氢
D. 若A、B、C均为焰色反应呈黄色的化合物,则X可能为CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】文献表明:工业上,向炽热铁屑中通入氯化氢生产无水氯化亚铁;相同条件下,草酸根(C2O42-)的还原性强于Fe2+。为检验这一结论,雅礼中学化学研究性小组进行以下实验:
资料:i. 草酸(H2C2O4)为二元弱酸。
ii. 三水三草酸合铁酸钾[K3Fe(C2O4)33H2O]为翠绿色晶体,光照易分解。其水溶液中存在[Fe(C2O4)3]3-![]() Fe3++3C2O42- K=6.3×10-21
Fe3++3C2O42- K=6.3×10-21
iii.FeC2O42H2O为黄色固体,溶于水,可溶于强酸。
(实验1)用以下装置制取无水氯化亚铁
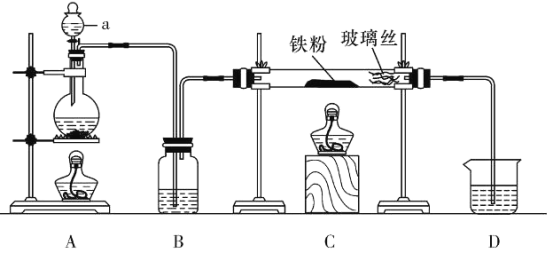
(1)仪器a的名称为___________。
(2)欲制得纯净的FeCl2,实验过程中点燃A、C酒精灯的先后顺序是___________。
(3)若用D的装置进行尾气处理,存在的问题是__________、___________。
(实验2)通过Fe3+和C2O42-在溶液中的反应比较Fe2+和C2O42-的还原性强弱。

(4)取实验2中少量晶体洗浄,配成溶液,漓加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是______________。
(5)经检验,翠绿色晶体为K3Fe(C2O4)33H2O。设计实验,确认实验2中没有发生氧化还原反应的操作和现象是_____。
(6)取实验2中的翠绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:_____Fe(C2O4)3]3-+____H2O![]() ____FeC2O4·2H2O↓+__________+_______
____FeC2O4·2H2O↓+__________+_______
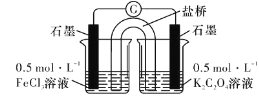
(实验3)研究性小组又设计以下装置直接比较Fe2+和C2O42-的还原性强弱,并达到了预期的目的。
(7)描述达到期目的可能产生的现象:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】RLClaisen双酯缩合反应的机理如下:2RCH2COOC2H5![]()
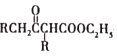 +C2H5OH,利用该反应制备化合物K的一种合成路线如图
+C2H5OH,利用该反应制备化合物K的一种合成路线如图
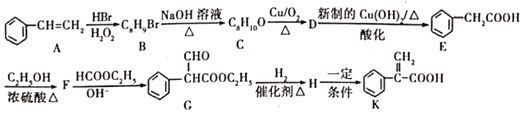
试回答下列问题:
(1)A与氢气加成所得芳香烃的名称为______;A→B的反应类型是______;D中含氧官能团的名称是______。
(2)C的结构简式为______;F→G的反应除生成G外,另生成的物质为______。
(3)H→K反应的化学方程式为______。
(4)含有苯环结构的B的同分异构体有______种(B自身除外),其中核磁共振氢谱显示3组峰的结构简式为______(任写一种即可)。
(5)乙酰乙酸乙酯(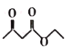 )是一种重要的有机合成原料,写出由乙醇制备乙洗乙酸乙時的合成路线(无机试剂任选):______。
)是一种重要的有机合成原料,写出由乙醇制备乙洗乙酸乙時的合成路线(无机试剂任选):______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com