
| A. | 玻璃钢 | B. | 钢化玻璃 | C. | 有机玻璃 | D. | 石英玻璃 |
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 该原子中子数与质子数之差为 19 | |
| B. | 他们获得了一种新元素 | |
| C. | ${\;}_{26}^{45}$Fe与${\;}_{26}^{56}$Fe的化学性质几乎完全相同 | |
| D. | 这种铁原子衰变出 2 个质子后变成${\;}_{26}^{43}$Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | ① | ② | ③ | ④ |
| 装置 |  |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
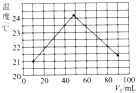 某化学兴趣小组要完成中和热的测定.
某化学兴趣小组要完成中和热的测定.| 实验编号 | 实验用品 | 溶液温度 | 中和热 | |
| t2-t1 | △H | |||
| ① | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.3℃ | ? |
| ② | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

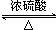 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
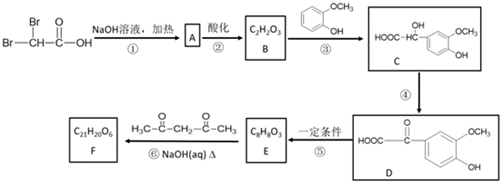
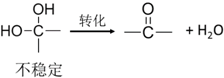

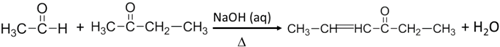
 .反应④的化学方程式是
.反应④的化学方程式是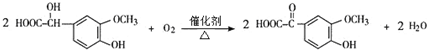 .
.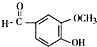 .F的结构简式是
.F的结构简式是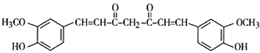 .
.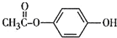 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com