
【题目】(1)COC12俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为________,其中碳氧原子之间共价键是________(填序号)。
a.2个σ键b.2个π键c.1个σ键,1个π键
(2)CaC2中C22﹣与O22+互为等电子体,O22+的电子式可表示为________。
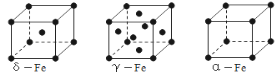
(3)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为________,δ、α两种晶胞中铁原子的配位数之比为______(填元素符号)。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分条件已略去),在通常状况下,B是黑色的金属氧化物,D、E、F是气体单质,C是一种水溶液显碱性的气体,I为红棕色气体,G为紫红色的金属。

(1)B的化学式为__________;A的结构式为___________;
(2)写出反应①的化学方程式:_____________________________;
(3)写出反应②的离子方程式: ___________ ,该反应是________(填“放热”或“吸热”)反应;
(4)实验室制备C时,检验是否收集满C的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液 X 中可能含有 Fe2+、Fe3+、Al3+、Ba2+、NH4+、CO32-、NO3-、SO42-、SiO32-中的若干种,现取 X 溶液进行连续实验,实验过程及产物如图所示。实验过程中有一种气体为红棕色。
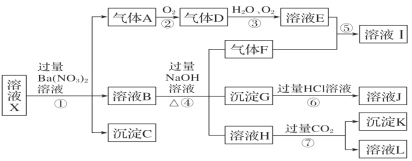
根据以上信息,回答下列问题:
(1)由强酸性条件即可判断 X 溶液中肯定不存在的离子有_____。
(2)溶液 X 中关于硝酸根离子的判断,正确的是_____(填编号,下同)。
a.一定含有 b.一定不含有 c.可能含有
(3)气体 F 的电子式为_____,化合物 I 中含有的化学键类型有_____。
(4)转化①的离子方程式为_____。 转化⑦的离子方程式为_________。
(5)对不能确定是否存在的离子,可以另取 X 溶液,加入下列溶液中的一种,根据现象即可判断, 该试剂最好是_____。
①NaOH 溶液 ②KSCN 溶液 ③氯水和 KSCN 的混合溶液 ④pH 试纸 ⑤KMnO4 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①CH2=CH2 ②![]() ③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
(1)属于高分子化合物的是_____;(请填物质的序号,下同。);
(2)能使Br2的CCl4溶液褪色的是______;
(3)既能发生取代反应又能发生加成反应的是________;
(4)能与Na2CO3溶液反应的是_____;
(5)能发生酯化反应的是_______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法.
Ⅰ.甲醇可以补充和部分替代石油燃料,缓解能源紧张,利用CO可以合成甲醇.
(1)已知:CO(g)+1/2O2(g)═CO2(g)ΔH1=-283.0kJ·mol-1
H2(g)+1/2O2(g)═H2O(l)ΔH2=-285.8kJ·mol-1
CH3OH(g)+3/2O2(g)═CO2(g)+2H2O(l)ΔH3=-764.6 kJ·mol-1
请写出CO与H2合成甲醇蒸汽的热化学方程式____________________
(2)一定条件下,在溶剂为VL的密闭容器中充入a molCO与2a molH2合成甲醇,平衡转化率与温度、压强的关系如图所示.

①该反应在A点的平衡常数K=_________________(用a和V表示)
②下列能说明反应达到平衡状态的是_____
A.v(CO)=v(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D. c(CO)=c(H2)
③写出能增大v(CO)又能提高CO转化率的一项措施_____________________________
Ⅱ.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池原理:该小组设计的原理示意图如左下图,写出该电池负极的电极反应式______。
(4)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如图,写出开始电解时阳极的电极反应式________________。


(5)已知25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,则该混合溶液中各离子浓度的大小顺序为________________________________(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示。该电池以空气中的氧气为氧化剂,以KOH溶液为电解质溶液。下列关于该电池的叙述正确的是
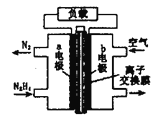
A. b极发生氧化反应
B. a极的反应式为N2H4+4OH--4e-=N2↑+4H2O
C. 放电时,电子从a极经过负载流向b极,再经溶液流回a极
D. 其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中能量变化的趋势与图一致的是( )

A. C + CO2![]() 2CO
2CO
B. CaCO3![]() CaO + CO2↑
CaO + CO2↑
C. 2Al + Fe2O3![]() 2Fe + Al2O3
2Fe + Al2O3
D. Ba(OH)2·8H2O + 2NH4Cl==BaCl2 + 2NH3↑+ 10H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com