
 .
. 科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和反应 | |
| B. | 不需要加热就能发生的反应 | |
| C. | 化学键断裂吸收的能量比化学键形成放出的能量少的反应 | |
| D. | 氢氧化钡晶体和氯化铵晶体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以海水为原料制得精盐,再电解精盐的水溶液制取钠 | |
| B. | 用海水、石灰乳等为原料,经一系列过程制得氧化镁,用H2还原氧化镁制得镁 | |
| C. | 以铁矿石、焦炭、空气、石灰石等为原料,通过反应产生的CO在高温下还原铁矿石制得铁 | |
| D. | 从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③⑤ | C. | ③④⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯乙烯和聚乙烯均能发生加成反应 | |
| B. |  和 和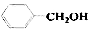 互为同系物 互为同系物 | |
| C. | 用新制氢氧化铜悬浊液能鉴别葡萄糖和乙酸 | |
| D. | 等质量的乙烯和乙醇完全燃烧,消耗氧气的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:A>D>B>C | B. | 原子半径:D>B>C>A | ||
| C. | 原子序数:C>D>B>A | D. | 简单离子半径:A>B>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,杂化方式为sp3,该物质难溶(填“可溶”或“难溶”)于水.
,杂化方式为sp3,该物质难溶(填“可溶”或“难溶”)于水. 与B:
与B: 的沸点高低及其原因:B>A,因为B可以形成分子间氢键
的沸点高低及其原因:B>A,因为B可以形成分子间氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com