
【题目】1,2-二氯丙烷(CH2ClCHClCH3)是重要的化工原料,工业上可用丙烯加成法生产,主要副产物为3-氯丙烯(CH2=CHCH2C1) ,反应原理为
i.CH2=CHCH,3(g)+Cl2(g)![]() CH2ClCHClCH3(g) ΔH1= -134 kJ mol-1
CH2ClCHClCH3(g) ΔH1= -134 kJ mol-1
ii.CH2=CHCH,3(g)+Cl2(g)![]() CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ mol-1
CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ mol-1
已知:相关化学键的键能数据如下表所示:
化学键 | C=C | C—C | C—Cl | Cl—Cl |
E/( kJ mol-1) | 611 | x | 328 | 243 |
请回答下列问题:
(1)由反应i计算出表中x=_____________。
(2)一定温度下,密闭容器中发生反应i和反应ii,达到平衡后增大压强,CH2C1CHC1CH3的产率______(填“增大”“减小”或“不变”),理由是_________________________________。
(3)T1℃时,向10L恒容的密闭容器中充入1 mol CH2=CHCH2C1和2 mol HC1,只发生反应CH2=CH CH2Cl (g)+HCl(g)![]() CH2ClCHClCH3(g) ΔH3。 5min反应达到平衡,测得 05 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 min-1。
CH2ClCHClCH3(g) ΔH3。 5min反应达到平衡,测得 05 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 min-1。
①平衡时,HCl的体积分数为_________(保留三位有效数字)。
②保持其它条件不变,6 min时再向该容器中充入0.6 mol CH2=CHCH2Cl、0.2molHC1和0.1mol CH2ClCHClCH3,则起始反应速率 v正(HCl)___ V逆(HCl) (填“>”“<”或“=”)。
【答案】332 增大增大压强,反应ii的平衡不移动,反应i的平衡正向移动。所以CH2C1CHC1CH3的产率增大54.5%>
【解析】
(1)利用反应热就是断键吸收的能量和形成化学键所放出的能量的差值计算;(2)增大压强,平衡向气体分子总数减小的方向移动;(3)由反应速率v(CH2C1CHC1CH3)计算平衡时生成CH2C1CHC1CH3的物质的量,进而计算平衡时HC1(g)的物质的量为1.2mol,再用差量法计算平衡时气体总物质的量;由题中数据,利用三段式法可计算出平衡时各物质的浓度,依据公式计算平衡常数,通过浓度熵判断平衡得移动方向。
(1)由反应i,△H=-134 kJ mol-1=611 kJ mol-1+ 243kJ mol-1—x—328 kJ·mol-1,解得x=332kJ·mol-1。(2)反应ii的左右两边气体分子总数相等,平衡不受压强影响,反应为气体分子总数减小的反应,增大压强,平衡正向移动,CH2C1CHC1CH3的产率增大。(3)①0.5min内,用CH2C1CHC1CH3表示的反应速率v(CH2C1CHC1CH3)= 0.016mol·L-1·min-1,平衡时生成CH2C1CHC1CH3的物质的量为0.8mo1,则平衡时HC1(g)的物质的量为1.2mol;再用差量法计算出平衡时气体总物质的量为3mo1-0.8mo1=2.2mo1,所以HC1的体积分数为![]() ×100%≈54.5%;②由题中数据,利用三段式法可计算出平衡时,CH2=CHCH2C1(g)、HC1(g)、 CH2C1CHC1CH3(g)的浓度分别为0.02mo1/L、0.12mo1/L、0.08mo1/L,则平衡常数K=
×100%≈54.5%;②由题中数据,利用三段式法可计算出平衡时,CH2=CHCH2C1(g)、HC1(g)、 CH2C1CHC1CH3(g)的浓度分别为0.02mo1/L、0.12mo1/L、0.08mo1/L,则平衡常数K=![]() =
=![]() ,6min时的浓度熵Q为
,6min时的浓度熵Q为![]() <
<![]() ,平衡正向移动,所以v正(HCl) >V逆(HCl)。
,平衡正向移动,所以v正(HCl) >V逆(HCl)。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝.下列说法不正确的是( )
铝土矿![]() a
a ![]() b
b![]()
![]() c
c![]()
![]() d
d![]() Al.
Al.
A. b中铝元素是以阳离子形式存在
B. ①、②中除加试剂外,还需要进行过滤操作
C. ④进行的操作是加热,而且d一定是氧化铝
D. ③中需要通入过量的二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年为“国际化学元素周期表年 IUPAC公布的118号元素符号为Og,至此元素周期表的七个周期均已填满,下列关于![]() Og的说法错误的是
Og的说法错误的是
A. 中子数为179B. 原子序数为118
C. 中子数比核电荷数多61D. ![]() Og原子的摩尔质量为297克
Og原子的摩尔质量为297克
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是四种常见有机物的比例模型,请回答下列问题:

(1)向丙中加入溴水,振荡静置后,观察到溶液分层,上层为_______色。
(2)甲的同系物的通式为CnH2n+2,当n=5时,写出含有3个甲基的有机物的结构简式_____。
下图是用乙制备D的基本反应过程

(3)A中官能团为__________。
(4)反应①的反应类型是__________。
(5)写出反应④的化学方程式_______。
(6)现有138gA和90gC发生反应得到80gD。试计算该反应的产率为______(用百分数表示,保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是高中化学常见的的氧化剂,工业上以铬铁矿为原料用碱溶氧化法制备。铬铁矿中通常含有Cr2O3、FeO、Al2O3、SiO2等。
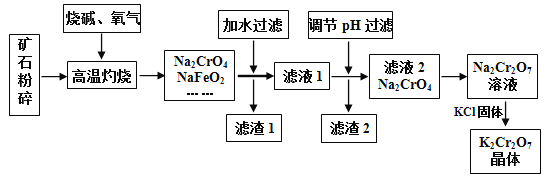
已知:
①NaFeO2常温遇大量水会强烈水解,高温时不与水反应
②2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
③+6价的铬元素在强酸性条件下具有强氧化性,还原产物为Cr3+,强碱性条件下几乎没有氧化性;请回答下列问题:
(1)将矿石粉碎的目的是___________________________。
(2)高温灼烧时生成NaFeO2的化学方程式____________________________________。
(3)①滤渣1中有红褐色物质,滤渣1的成分为__________________(写化学式,下同),写出生成该物质反应的离子方程式___________________________。
②滤渣2的主要成分是__________________。
(4)若向Na2CrO4溶液中加入浓盐酸进行酸化,出现的现象为__________________
(5)生产后的废水中主要含有一定量的Cr2O72-,通常加一定量的绿矾进行净化并调节pH约为6,可生成两种难溶于水的沉淀,请写出该反应的离子方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
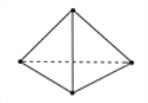
【题目】(一):意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,则1 mol N4生成N2的 ΔH=______________
(二):50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
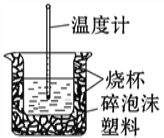
(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________________。
(2)烧杯间填满碎纸条的作用是__________________________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值_________________(填“偏大”、“偏小”或“无影响”)。
(4)实验中60 mL0.50 mol/L盐酸与50 mL0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”或“不相等”),所求中和热_________(填“相等”或“不相等”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次价值倍也”。这里用到的实验方法可用于分离
A. CCl4和水 B. 酒精和水 C. 食盐水和泥沙 D. 硝酸钾和硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化钠溶于水,溶液温度显著升高的原因是
A.氢氧化钠溶于水只发生扩散作用
B.氢氧化钠溶于水只发生水合作用
C.氢氧化钠溶于水扩散过程吸收热量大于水合过程放出的热量
D.氢氧化钠溶于水扩散过程吸收热量小于水合过程放出的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com