
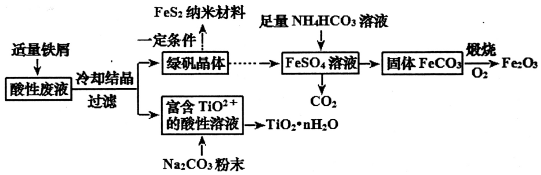
分析 钛矿的酸性废液(含TiO2+、Fe2+、Fe3+、SO42-等),①溶液呈强酸性,该过程中有如下反应发生:2Fe3++Fe=3Fe2+;冷却结晶得到绿矾FeSO4.7H2O和含有TiO2+的酸性溶液,向溶液加入碳酸钠粉末,降低溶液酸性,得到TiO2•nH2O,
绿矾晶体可制备FeS2纳米材料,将绿矾晶体溶解为FeSO4溶液,加入足量的碳酸氢铵溶液,发生反应:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,将得到的固体FeCO3与氧气煅烧生成Fe2O3,据此分析解答.
解答 解:(1)TiO2+中氧元素-2价,则钛元素+4;TiO2+只能存在于强酸性溶液中,因为TiO2+易水解生成TiO2•nH2O,水解的反应物为:TiO2++(n+1)H2O?TiO2•nH2O+2H+;
故答案为:+4; TiO2++(n+1)H2O?TiO2•nH2O+2H+;
(2)含有TiO2+的酸性溶液,存在平衡TiO2++(n+1)H2O?TiO2•nH2O+2H+,向溶液加入碳酸钠粉末,Na2CO3消耗H+,c(H+)减少,使TiO2+水解平衡向生成TiO2•nH2O方向移动;
故答案为:Na2CO3消耗H+,c(H+)减少,使TiO2+水解平衡向生成TiO2•nH2O方向移动;
(3)NH4HCO3溶液与FeSO4溶液反应生成FeCO3和二氧化碳,离子方程式为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;该反应需控制温度在308K以下,防止NH4HCO3受热分解和减少Fe2+的水解,使FeCO3的生成损失;
故答案为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;防止NH4HCO3受热分解和减少Fe2+的水解;
(4)已知298K时,Ksp[Fe(OH)2]=8.0×10-16,若在生成的FeCO3达到沉淀溶解平衡时,测得溶液的pH为8.5,c(OH-)=1×10-5.5,c(Fe2+)=1.0×10-5mol•L-1,此时溶液中c(Fe2+)•c(OH-)2=1×10-5×(1×10-5.5)2=1×10-16<Ksp[Fe(OH)2]=8.0×10-16,故无Fe(OH)2沉淀生成;
故答案为:没有;
(5)FeS2纳米材料可用于制造高容量锂电池,电池放电时的总反应为:4Li+FeS2═Fe+2Li2S,正极发生还原反应,则正极为FeS2反应,反应式为:FeS2+4e-=Fe+2S2-;
故答案为:FeS2+4e-=Fe+2S2-.
点评 本题考查物质的制备、为高考常见题型,题目难度中等,侧重于学生的分析能力、实验能力的考查,注意把握实验的原理和目的,为解答该类题目的关键,注意物质的性质,结合题给信息解答,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
 已知甲醇、乙醇都是重要的有机化工原料,回答下列问题:
已知甲醇、乙醇都是重要的有机化工原料,回答下列问题:| 化学反应及平衡常数 | 平衡常数数值 | ||
| 500℃ | 800℃ | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | 2.5 | 0.375 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融的AlCl3生产铝单质 | |
| B. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 | |
| C. | 用Ba(OH)2溶液可鉴别NaCl、AlCl3、NH4Cl、Na2SO4四种溶液 | |
| D. | 用分液漏斗从食醋中分离出乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、AlO2-、CO32- | B. | K+、Ba2+、SO42- | C. | NH4+、OH-、NO3- | D. | Fe3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8gNH4+中含有的电子数为NA | |
| B. | 标准状况下,足量Na2O2与22.4LCO2气体充分反应,转移电子数为2NA | |
| C. | 2molSO2和1molO2在一定条件下充分反应,所得混合气体的分子数等于2NA | |
| D. | 298K时,1.0LpH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知NO2与以SO2能发生反应:NO2(g)+SO2(g)?SO3(g)+NO(g).
已知NO2与以SO2能发生反应:NO2(g)+SO2(g)?SO3(g)+NO(g).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 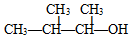 的命名为:3-甲基-2-丁醇 的命名为:3-甲基-2-丁醇 | |
| B. | 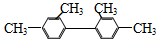 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 | |
| C. | 羟基的电子式是 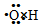 | |
| D. | 软脂酸和油酸互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该固体中一定含有NH4+、Cl-、SO42-、Na+ | |
| B. | 根据以上实验,无法确定该固体中有Cl- | |
| C. | 该固体中只含有NH4+、Fe3+、SO42-、Cl- | |
| D. | 该固体中一定没有I-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、SO32-、AlO2- | B. | NH4+、Br-、CO32- | ||
| C. | Fe2+、S2-、SO32- | D. | NH4+、Br-、AlO2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com