
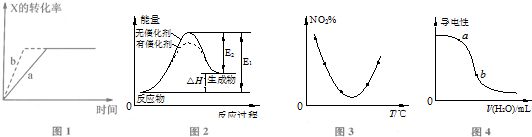
| A. | 图1所示反应:X(g)+2Y(g)?3Z(g),b曲线表示的一定是增大压强 | |
| B. | 图2表示催化剂能改变化学反应的焓变 | |
| C. | 图3表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)═N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| D. | 图3表示向稀CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
分析 A、b曲线表示的反应比a反应速率快,平衡不移动;
B、催化剂能够降低反应的活化能,不影响焓变;
C、由图可知,反应平衡后升高温度N02的含量增大,平衡逆移,正方向为放热反应;
D、CH3COOH溶液中导电性越强,氢离子浓度越大,pH越小.
解答 解:A、图1所示反应:X(g)+2Y(g)?3Z(g),b曲线表示的可以是使用催化剂,故A错误;
B、催化剂不影响焓变大小,故B错误;
C、由图可知,反应平衡后升高温度N02的含量增大,平衡逆移,正方向为放热反应,所以该反应的△H<0,故C正确;
D、CH3COOH溶液中导电性越强,氢离子浓度越大,pH越小,则CH3COOH溶液的pH:a<b,故D错误;
故选C.
点评 本题考查了化学图象、阅读题目获取信息的能力等,难度中等,需要学生具备运用信息与基础知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:填空题
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl HBr HI |
| 能量 | 243 | 193 | 151 | 436 | 568 | 432 366 298 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 使用催化剂 | ||
| C. | 充入稀有气体,增大体系压强 | D. | 增加N2和H2的起始量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ) 4种有机物分别在一定条件下与H2充分反应.
) 4种有机物分别在一定条件下与H2充分反应. 滴入溴水后,反应生成产物的结构简式为
滴入溴水后,反应生成产物的结构简式为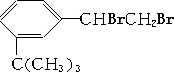 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
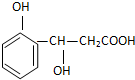 某有机物的结构简式如图,它可能发生的反应类型有:①取代 ②加成 ③消去 ④水解 ⑤酯化 ⑥中和 ⑦氧化 ⑧加聚( )
某有机物的结构简式如图,它可能发生的反应类型有:①取代 ②加成 ③消去 ④水解 ⑤酯化 ⑥中和 ⑦氧化 ⑧加聚( )| A. | ①②③⑥⑧ | B. | ②③④⑤⑧ | C. | ①②③⑤⑥⑦ | D. | ③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com