
分析 地壳中含量最多的金属元素是铝,13号元素铝位于第三周期、第ⅢA族;取出洗净再放入硝酸汞溶液中,表面逐渐附着一层灰白色的固体,取出后用滤纸轻轻地将其表面吸干,然后将其置于干燥的滤纸上,片刻后即观察到,其表面生出白色毛状物,因为取出洗净再放入硝酸汞溶液中,发生置换反应生成Hg,因Hg性质不活泼,不能被氧化生成氧化物,则未反应的Al被氧化生成氧化铝,以此来解答.
解答 解:地壳中含量最多的金属元素是铝,13号元素铝位于第三周期、第ⅢA族;现象其表面生出白色毛状物,该现象可用化学反应方程式可表示为:4Al+3O2=2Al2O3,氧化铝为两性氧化物,与盐酸反应生成氯化铝和水,反应方程式为:Al2O3+6HCl=2AlCl3+3H2O;也能够与氢氧化钠溶液反应生成偏铝酸钠和水,反应方程式为:Al2O3+2NaOH=2NaAlO2+H2O,故答案为:铝;第三周期、第ⅢA族;表面生出白色毛状物;4Al+3O2=2Al2O3;Al2O3+6HCl=2AlCl3+3H2O;Al2O3+2NaOH=2NaAlO2+H2O.
点评 本题考查Al及其氧化物的性质,为高频考点,把握金属片进入烧碱溶液的作用及发生的反应为解答的关键,注意Hg性质不活泼,题目难度不大.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.46 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COOH)=0.01 mol•L-1 | |
| B. | c(H+)=c(CH3COO-) | |
| C. | 加水稀释100倍后,溶液pH=4 | |
| D. | 加入CH3COONa固体,可抑制CH3COOH的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾充分加热后的剩余固体、碘酒、空气都是混合物 | |
| B. | Na2O和NH3的水溶液均能导电,故均为电解质 | |
| C. | 氧化还原反应中非金属单质只作氧化剂 | |
| D. | 酸碱中和反应的实质是H+与OH-结合生成水,故酸碱中和反应都可用H++OH-═H2O表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构的相关叙述 |
| T | 失去一个电子后,形成与Ne相同的核外电子排布 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其某种单质是空气的主要成分,也是最常见的助燃剂 |
| Z | 原子核外有3个电子层,最外层比次外层少1个电子 |
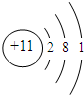 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 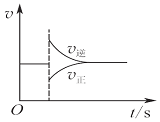 图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 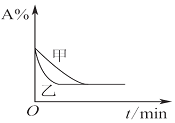 图表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(g)的影响,且甲的压强大 | |
| C. | 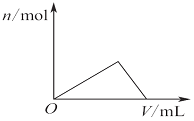 图表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液体积的关系 | |
| D. | 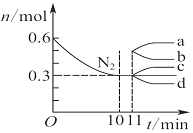 图表示在2 L的密闭容器中发生合成氨反应时N2的物质的量随时间的变化曲线,0~10 min内该反应的平均速率v(H2)=0.045 mol•L-1•min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com