
| A. | 16:25 | B. | 1:7 | C. | 1:6 | D. | 2:11 |
分析 根据FeS化学式可知,溶液中铁离子与硫酸根离子的物质的量相等,令参加反应的FeS为1mol,则溶液中Fe2(SO4)3为$\frac{1}{3}$mol,Fe(NO3)3为$\frac{1}{3}$mol,反应中Fe元素、S元素化合价升高,N元素化合价降低,根据电子转移守恒计算NO2、N2O4、NO各的物质的量,进而计算起氧化剂作用的HNO3,参加反应的硝酸为起氧化剂作用的硝酸与起酸作用的硝酸之和,以此解答该题.
解答 解:令参加反应的FeS为1mol,则溶液中Fe2(SO4)3为$\frac{1}{3}$mol,Fe(NO3)3为$\frac{1}{3}$mol,
反应中Fe元素、S元素化合价升高,N元素化合价降低,令NO2、N2O4、NO的物质的量分别为4amol、amol、4amol,
根据电子转移守恒有:1×(3-2)+1×[6-(-2)]=4a×(5-4)+a×(5-4)×2+4a×(5-2),
解得a=0.5,故NO2、N2O4、NO的物质的量分别为2mol、0.5mol、2mol,
故起氧化剂作用的HNO3为2mol+0.5mol×2+2mol=5mol,起酸的作用的硝酸生成Fe(NO3)3,
故起酸的作用的硝酸为$\frac{1}{3}$mol×3=1mol,参加反应的硝酸为5mol+1mol=6mol,
故实际参加反应的FeS与HNO3的物质的量之比为1mol:6mol=1:6,
故选C.
点评 本题考查氧化还原反应有关计算,为高频考点,侧重考查学生的分析能力和计算能力的考查,难度中等,利用电子转移守恒与元素守恒计算是关键,转移守恒思想在氧化还原反应计算中的运用.


科目:高中化学 来源: 题型:选择题
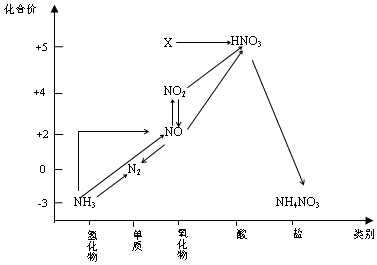
| A. | X是N2O5 | |
| B. | 可用排空气法收集NO气体 | |
| C. | 工业上以NH3、空气、水为原料生产硝酸 | |
| D. | 由NH3→N2,从原理上看,NH3可与NO2反应实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,加入铝粉能够产生氢气的溶液中水电离的c(H+)一定小于10-7mol•L-1 | |
| B. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.在含Cl-、CrO42-浓度相同的溶液中滴加稀AgNO3溶液时,先生成Ag2CrO4沉淀 | |
| C. | 温度一定时,强电解质溶液的导电能力一定比弱电解质溶液强 | |
| D. | 实验室用锌制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A元素最简单的氢化物的电子式为
A元素最简单的氢化物的电子式为 .
.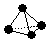 ,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.写出B4转化为B2的热化学方程式:N4(g)=2N2(g)△H=-882kJ•mol-1;
,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.写出B4转化为B2的热化学方程式:N4(g)=2N2(g)△H=-882kJ•mol-1;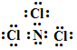 ;X遇水蒸气可形成一种常见的漂白性物质.则X与水反应的化学方程式是NCl3+3H2O=NH3↑+3HClO.
;X遇水蒸气可形成一种常见的漂白性物质.则X与水反应的化学方程式是NCl3+3H2O=NH3↑+3HClO.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物理量 | V(0.20mol/H2 | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 25 | |
| ③ | 1.0 | a | 4.0 | 25 |
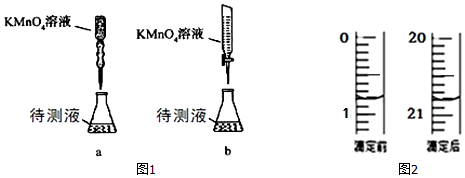
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
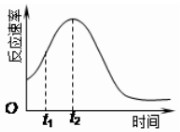 某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种.
某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种.| 试管A | 试管B | |
| 加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4,少量MnSO4(s)固体(填物质名称) |
| 实验现象(褪色时间) | 褪色时间10min | 褪色时间<10min(选填“<”“>”或“=”) |
| 结论 | 猜想Ⅱ正确 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素一定被氧化 | B. | 该元素一定被还原 | ||
| C. | 该元素可能被氧化也可能被还原 | D. | 生成的单质为还原产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com