
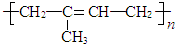 .
.分析 ①不锈钢不易生锈,是因为在普通钢中添加了铬、镍等元素,改变了钢的结构;
②天然橡胶的成分为聚异戊二烯;
③水泥的原料是粘土和石灰石,玻璃的原料是纯碱、石灰石和石英,所以原料中均有石灰石即碳酸钙;有机玻璃的成分是聚甲基丙烯酸甲酯是一种塑料;根据质量守恒定律书写方程式.
解答 解:①不锈钢用品在普通钢中添加了铬、镍等元素形成合金,改变了钢的结构,不易生锈,
故答案为:铬(Cr);
②天然橡胶的成分为聚异戊二烯,结构简式为: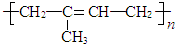 ,
,
故答案为: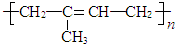 ;
;
③生产玻璃的原料是纯碱、石灰石和石英,高温下,碳酸钠、碳酸钙和二氧化硅反应分别生成硅酸钠、硅酸钙;生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥;所以在玻璃工业、水泥工业中都用到的原料是石灰石,有机玻璃的成分是聚甲基丙烯酸甲酯是一种塑料;工业上用石英砂与焦炭高温下条件下生成SiC同时生成CO,方程式为:SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,
故答案为:CaCO3(石灰石);塑料;SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
点评 本题主要考查了化学与生活中的材料知识,平时注意基础知识的积累,注意玻璃工业、水泥工业的生产原理,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | CO2 | B. | NH3 | C. | Cl2 | D. | NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率变化时,化学平衡一定发生移动 | |
| B. | 正反应进行的程度大、正反应速率一定大 | |
| C. | 化学平衡发生移动时、化学反应速率一定变化 | |
| D. | 只有催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下水电离出的c(H+)•c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32- | |
| B. | 滴加无色酚酞后仍为无色的溶液:Na+、CO32-、K+、ClO-、SO42- | |
| C. | 加入(NH4)2Fe(SO4)2•6H2O晶体的溶液中:Na+、H+、Cl-、NO3- | |
| D. | 常温下,pH<7的溶液中:I-、SO42-、Al3+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水的反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 硫酸铝溶液与氨水的反应:Al3++3OH-=Al(OH)3↓ | |
| C. | 氢氧化铜与稀硫酸的反应:OH-+H+=H2O | |
| D. | 铁粉与稀盐酸反应:Fe+2H+=Fe2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物 | |
| B. | 玛瑙和红宝石的主要成分都是SiO2,SiO2和Si都是制造半导体的材料 | |
| C. | 高温下SiO2能与Na2CO3反应放出CO2,说明H2SiO3的酸性强于H2CO3 | |
| D. | Na2SiO3溶液中加入盐酸可制备硅酸胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 途径①反应中体现了浓硝酸的强氧化性和酸性 | |
| B. | 途径②的第二步反应在实际生产中可以通过增大O2浓度来提高产率 | |
| C. | 由途径①和②分别制取1mol H2SO4,理论上各消耗1mol S,各转移6mol电子 | |
| D. | 途径②与途径①相比更能体现“绿色化学”理念,是因为途径②比途径①污染相对小且原子利用率高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的无色溶液中:Cl-、Na+、SO42-、Fe2+ | |
| B. | 含有大量Fe3+的溶液中:Al3+、SCN-、Br-、Na+ | |
| C. | 加入铝粉能放出H2的溶液中:Mg2+、NH4+、NO3-、Cl- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、NO3-、K+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com