
【题目】无机物可根据其组成和性质进行分类。现有Cl2、Na、CO2、Na2O、Na2O2、NH3六种物质,完成下列填空:
(1)由分子构成的单质是____________,属于极性分子的是____________。
(2)既有离子键又有共价键的物质的电子式为____________。
(3)上述化合物中组成元素的原子半径由大到小的顺序是____________。
(4)根据与水反应的不同,上述物质可分成A组(CO2、Na2O和NH3)和B组(Cl2、Na和Na2O2),分组的依据是________________________。
(5)在酸性高锰酸钾溶液中加入Na2O2,溶液褪色,发生反应![]() (未配平),配平该反应的离子方程式并标出电子转移方向与数目。____________
(未配平),配平该反应的离子方程式并标出电子转移方向与数目。____________
【答案】Cl2 NH3 ![]() Na>C>N>O>H 与水反应是否是氧化还原反应
Na>C>N>O>H 与水反应是否是氧化还原反应 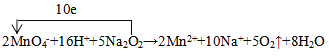
【解析】
(1)单质分子只有一种元素构成,极性分子的正负电荷重心不重叠;
(2)既有离子键又有共价键的物质只有过氧化钠;
(3)上述化合物中组成元素有H、C、N、O、Na,结合原子半径的递变规律判断;
(4)两组反应的区别为是否为氧化还原反应;
(5)反应中Mn元素化合价降低5价,O元素化合价升高1价,化合价升高值=化合价降低值=转移电子数。
(1)由分子构成的单质是Cl2,属于极性分子的是NH3;
答案是:Cl2; NH3;
(2)既有离子键又有共价键的物质为过氧化钠,电子式为![]() ;
;
答案是:![]() ;
;
(3)上述化合物中组成元素有H、C、N、O、Na,由同周期元素从左到右原子半径逐渐减小,同主族从上到下逐渐增大可以知道原子半径大小顺序为Na> C> N> O>H;
答案是:Na>C>N>O>H;
(4)两组反应的区别为与水反应是否是为氧化还原反应;
答案是:与水反应是否是氧化还原反应;
(5)在2MnO4-+12H++5Na2O2=2Mn2++5O2+8H2O+10Na+中,2MnO4-→2Mn2+,Mn元素的化合价由+7价→+2价,得到2×5e-,Mn元素的化合价降低其所在的物质高锰酸钾是氧化剂;5Na2O2→5O2,O元素的化合价由-1价→0价,失去10e-,电子转移情况如下: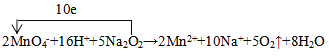 ;
;
答案是: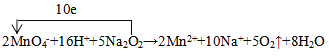 。
。


科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
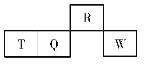
A.最高价氧化物对应水化物的酸性:Q<W
B.最简单气态氢化物的热稳定性:R>Q
C.原子半径:T>Q>R
D.含T的盐中,T元素只能存在于阳离子中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石。晶体硅(熔点1410℃)用途广泛,制取与提纯方法有多种。
(1)炼钢开始和结束阶段都可能发生反应: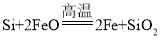 ,其目的是________。
,其目的是________。
A.得到副产品硅酸盐水泥 B.制取SiO2,提升钢的硬度
C.除去生铁中过多的Si杂质 D.除过量FeO,防止钢变脆
(2)一种由粗硅制纯硅过程如下:![]() 在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:_______。对于钠的卤化物(NaX)和硅的卤化物(SiX4)下列叙述正确的是(_________)
在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:_______。对于钠的卤化物(NaX)和硅的卤化物(SiX4)下列叙述正确的是(_________)
A.NaX易水解 B.SiX4是共价化合物
C.NaX的熔点一般高于SiX4 D.SiF4晶体是由共价键形成的空间网状结构
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解也可以生成高纯硅。硅烷的热稳定性弱于甲烷, 所以Si元素的非金属性弱于C元素,用原子结构解释其原因:_______。
(4)此外,还可以将粗硅转化成三氯氢硅(SiHCl3),通过反应:SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g)制得高纯硅。不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是(__________)(填字母序号)。
Si(s)+3HCl(g)制得高纯硅。不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是(__________)(填字母序号)。
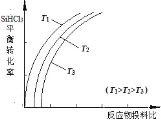
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是![]()
c.实际生产中为提高SiHCl3的利用率,可适当降低压强
(5)硅元素最高价氧化物对应的水化物是H2SiO3。室温下,0.1mol/L的硅酸钠溶液和0.1mol/L的碳酸钠溶液,碱性更强的是_______,其原因是_______。
已知:H2SiO3:Ki1=2.0×10-10,Ki2=1.0×10-12;H2CO3:Ki1=4.3×10-7,Ki2=5.6×10-11。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究影响化学反应速率的因素时,将H2C2O4溶液滴入KMnO4酸性溶液中,一段时间后,溶液突然变成无色,发生反应:KMnO4+H2C2O4+H2SO4![]() K2SO4+MnSO4+CO2+H2O(没有配平)。下列有关说法错误的是
K2SO4+MnSO4+CO2+H2O(没有配平)。下列有关说法错误的是
A. H2C2O4中C的化合价为+3
B. 每生成22.4 L(标况)CO2,转移电子2 mol
C. 该反应中,氧化剂与还原剂物质的量之比为2 :5
D. 溶液突然褪色的原因是产物MnSO4对该反应有催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用滴有酚酞和氯化钠溶液湿润的滤纸分别做甲、乙两个实验,下列判断错误的是( )

A.b极附近有气泡冒出B.d极附近出现红色
C.a、c极上都发生氧化反应D.甲中铁棒比乙中铁棒更易腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组选用下列装置,利用反应![]() ,通过测量生成水的质量
,通过测量生成水的质量![]() 来测定Cu的相对原子质量。实验中先称取氧化铜的质量
来测定Cu的相对原子质量。实验中先称取氧化铜的质量![]() 为a g。
为a g。
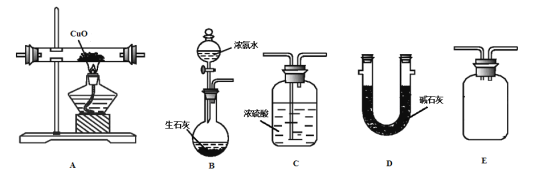
(1)浓氨水滴入生石灰中能制得NH3的原因是______________。
(2)甲同学按B-A-E-C-D的顺序连接装置,该方案是否可行__________,理由是_______________。
(3)乙同学按B-A-D-E-C的顺序连接装置,则装置C的作用是___________________________。
(4)丙同学认为乙同学测量的![]() 会偏高,理由是_____,你认为该如何改进?___
会偏高,理由是_____,你认为该如何改进?___
(5)若实验中测得![]() g,则Cu的相对原子质量为_______。(用含a,b的代数式表示)。
g,则Cu的相对原子质量为_______。(用含a,b的代数式表示)。
(6)若CuO中混有Cu,则该实验测定结果_________。(选填“偏大”、“偏小”或“不影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化工生产原理的叙述中,不符合目前工业生产实际的是
A.硫酸工业中,三氧化硫在吸收塔内被水吸收制成浓硫酸
B.炼铁工业中,用焦炭和空气反应产生的一氧化碳在高温下还原铁矿石中的铁
C.合成氨工业中,用铁触媒作催化剂,可提高单位时间氨的产量
D.氯碱工业中,电解槽的阴极区产生NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为 2Ag + Cl2 = 2AgCl。已知阳离子交换膜只允许阳离子通过,阴离子不能通过,离子交换过程中溶液电荷守恒。下列说法正确的是
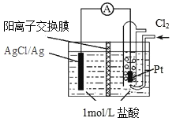
A.正极反应式为 AgCl + e—= Ag + Cl—
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用 NaCl 溶液代替盐酸,则电池总反应随之改变
D.当外电路中转移 0.1mol e—时,阳离子交换膜左侧溶液中约减少0.2mol 离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数,下列说法正确的是( )
A.6.2g白磷分子(P4)中含P-P键数为0.05NA
B.1mol CH3+含电子数为8NA
C.标准状况下,22.4LSO3中含原子数为4NA
D.常温常压下,11.2LCO2气体通过足量Na2O2充分反应,转移电子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com