
 ��Դ��ȱ������������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��Դ��ȱ������������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
���� ��1���١�ԭ�Ӿ��á���ָ�ڻ�ѧƷ�ϳɹ����У����õ�����ԭ���Ͼ����ܶ��ת�������ղ����У�
���ɱ����ݿ�֪���¶����ߣ�ƽ�ⳣ����С��˵��ƽ��������У�
�۰���Ӧ���ַ�Ӧ�ﵽƽ����c��CH3OH��=0.8mol/L�������ʵ���Ϊ1.6mol����
CO ��g��+2H2 ��g��?CH3OH ��g��
��ʼ����mol����2 6 0
�仯����mol����1.6 3.2 1.6
ƽ������mol����0.4 2.8 1.6
COת����=$\frac{����CO���ʵ���}{CO��ʼ���ʵ���}$��100%������K=$\frac{c��C{H}_{3}OH��}{c��CO����{c}^{2}��{H}_{2}��}$����ƽ�ⳣ���������ж��¶ȣ�
�ܿ��淴Ӧ����ƽ��ʱ��ͬ�����ʵ�����������ȣ�����ֵ�Ũ�ȡ��������ֲ��䣬�ɴ�����������һЩ�����䣬�ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����仯˵������ƽ�⣻
��2��1mol�״�ȼ�շų�������Ϊ363.26kJ��$\frac{1mol��32g/mol}{16g/mol}$=726.52 kJ��ע�����ʵľۼ�״̬�뷴Ӧ����д�Ȼ�ѧ����ʽ��
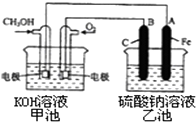
��3����ԭ��ظ�������������Ӧ����Ӧ�м״�����������Ӧ��ʧȥ���ӣ���������������̼���������ˮ��
�ڵ�����A���ӵ�Դ��������AΪ������B���ӵ�Դ������BΪ�����������Ϸ���������Ӧ�����������ӷŵ�����������ˮ��
�۵����ܷ�ӦΪ2H2O$\frac{\underline{\;���\;}}{\;}$2H2��+O2�������ݵ���ת���غ�����������������ʵ�����
��� �⣺��1���١�ԭ�Ӿ��á���ָ�ڻ�ѧƷ�ϳɹ����У����õ�����ԭ���Ͼ����ܶ��ת�������ղ����У�������Ӧ��֪����Ӧ����ԭ��������Ϊ100%�����ϡ�ԭ�Ӿ��á����ʴ�Ϊ����
���ɱ����ݿ�֪���¶����ߣ�ƽ�ⳣ����С��˵��ƽ��������У����������ȷ�Ӧ��������ȷ�Ӧ������H1��0���ʴ�Ϊ������
�۰���Ӧ���ַ�Ӧ�ﵽƽ����c��CH3OH��=0.8mol/L�������ʵ���Ϊ1.6mol����
CO ��g��+2H2 ��g��?CH3OH ��g��
��ʼ����mol����2 6 0
�仯����mol����1.6 3.2 1.6
ƽ������mol����0.4 2.8 1.6
CO��ת����=$\frac{1.6mol}{2mol}$��100%=80%��
��ʱ��ƽ�ⳣ��K=$\frac{c��C{H}_{3}OH��}{c��CO����{c}^{2}��{H}_{2}��}$=$\frac{\frac{1.6}{2}}{\frac{0.4}{2}����\frac{2.8}{2}��^{2}}$��2.041�������¶�Ϊ250�棬
�ʴ�Ϊ��80%��250�棻
��a�����������ʵ�Ũ�ȱ��ֲ��䣬˵����Ӧ����ƽ�⣬��a��ȷ��
b���淴Ӧ���У��������������ʵ������У�������ѹǿ��С��������ѹǿ���ֲ��䣬˵����Ӧ����ƽ�⣬��b��ȷ��
c���ɷ���ʽ��֪�ԣ�CO�������T$\frac{1}{2}$�ԣ�H2�����������ԣ�CO�������T$\frac{1}{2}$�ԣ�H2��������˵���ԣ�CO�������T�ԣ�CO����������Ӧ����ƽ��״̬����c��ȷ��
d������������������䣬�����ݻ�ʼ�ղ��䣬�����ڵ��ܶ�ʼ�ձ��ֲ��䣬��d����
��ѡ��d��
��2��1mol�״�ȼ�շų�������Ϊ363.26kJ��$\frac{1mol��32g/mol}{16g/mol}$=726.52 kJ���Ȼ�ѧ����ʽΪ��CH3OH��l��+$\frac{3}{2}$O2��g ���TCO2��g ��+2H2O��l����H1=-726.52 kJ/mol��
�ʴ�Ϊ��CH3OH��l��+$\frac{3}{2}$O2��g ���TCO2��g ��+2H2O��l����H1=-726.52 kJ/mol��
��3����ԭ��ظ�������������Ӧ����Ӧ�м״�����������Ӧ���״������ĵ缫ӦΪ�������״�ʧȥ���ӣ���������������̼���������ˮ�������缫��ӦʽΪ��CH3 OH-6e-+8OH-�TCO32-+6H2O��
�ʴ�Ϊ������b��
�ڵ�����A���ӵ�Դ��������AΪ������B���ӵ�Դ������BΪ�����������Ϸ���������Ӧ�����������ӷŵ�����������ˮ�������缫��ӦʽΪ����4 OH--4 e-�TO2��+2H2O��
�ʴ�Ϊ��������4 OH--4 e-�TO2��+2H2O��
�۱���£�3.36L �������ʵ���Ϊ$\frac{3.36L}{22.4L/mol}$=0.15mol�������ܷ�ӦΪ2H2O$\frac{\underline{\;���\;}}{\;}$2H2��+O2�������ݵ���ת���غ㣬�����������������ʵ���Ϊ3��0.15mol=0.45mol��
�ʴ�Ϊ��0.45mol��
���� ���⿼�黯ѧƽ����㡢ƽ��״̬�жϡ��Ȼ�ѧ����ʽ��д���绯ѧ�ȣ��Ƕ�ѧ���ۺ��������飬��Ҫѧ���������ջ���֪ʶ�����Ӧ�ã��Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017���������ʮ���и�����10���¿���ѧ�Ծ��������棩 ���ͣ������
NaCN����ĵ�Ʒ�ˮ��������������������
(1)NaCN��NaClO��Ӧ������NaOCN��NaCl
(2)NaOCN��NaClO��Ӧ������Na2CO3��CO2��NaCl��N2
��֪HCN(Ki=6.3��10-10)�о綾��HCN��HOCN��NԪ�صĻ��ϼ���ͬ��
���������գ�
(1)��һ������ʱ����Һ��pHӦ����Ϊ____________(ѡ����ԡ��������ԡ������ԡ�)��ԭ����______________________��
(2)д���ڶ�������ʱ������Ӧ�����ӷ���ʽ_________________________��
(3)����100 m3��NaCN 10.3 mg/L�ķ�ˮ��ʵ��������NaClO__ _g(ʵ������ӦΪ����ֵ��4��)������ʹNaCN��������0.5 mg/L���ﵽ�ŷű���
(4)(CN)2��Cl2�Ļ�ѧ�������ơ�(CN)2��NaOH��Һ��Ӧ����_________��__________��H2O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ����� |  | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| A | B | C | D | |
| SO3 | 0mol | 4mol | 2mol | 0mol |
| SO2 | 4mol | 1.5mol | 0mol | 4mol |
| O2 | 2mol | 0mol | 0mol | 4mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
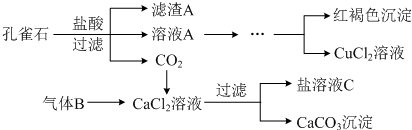
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ķ���ʽ��P | B�� | ������Ľṹʽ��H-Cl-O | ||
| C�� | �����ӵĽṹʾ��ͼ�� | D�� | ��������ĵ���ʽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
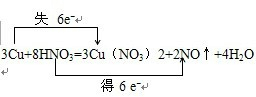 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com