
| A. | 溶液中阴离子向正极移动 | |
| B. | 溶液中阴离子物质的量减少 | |
| C. | 负极的电极反应式是:N2H4+4OH--4e-═4H2O+N2↑ | |
| D. | 正极的电极反应式是:O2+4H++4e-═2H2O |
分析 肼(N2H4)一空气燃料电池中,电池总反应为:N2H4+O2=N2↑+2H2O,则负极反应为:N2H4+4OH--4e-=4H2O+N2↑,正极反应为:O2+2H2O+4e-=4OH-,原电池中,阴离子向负极移动,阳离子向正极移动,据此解答.
解答 解:A、原电池中,阴离子向负极移动,阳离子向正极移动,故A错误;
B、电池总反应为N2H4+O2=N2↑+2H2O,原电池反应生成水,则阴离子物质的量基本不变,故B错误;
C、原电池中负极发生氧化反应,正极发生还原反应,负极反应为N2H4+4OH--4e-=4H2O+N2↑,故C正确;
D、在碱性环境下,正极反应为:O2+2H2O+4e-=4OH-,故D错误;
故选C.
点评 本题考查原电池的工作原理,题目难度不大,本题注意把握电极反应式的书写,正确判断离子的定向移动.


科目:高中化学 来源: 题型:选择题
| A. | K+、Cl-、MnO4-、SO42- | B. | Na+、K+、AlO2-、NO3- | ||
| C. | Na+、NO3-、SO42-、HCO3- | D. | Na+、Cu2+、NO3-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
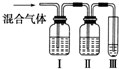 为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应.
为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
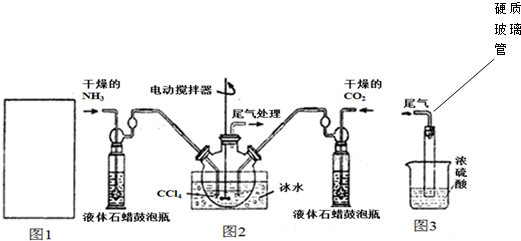
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ②④⑥⑦ | C. | ①③④⑤⑦ | D. | 全部都是 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 粒子代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
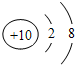 ,b粒子的电子排布式1s22s22p6.
,b粒子的电子排布式1s22s22p6. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
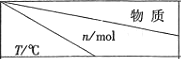 | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有强氧化性,故不可用作干燥二氧化硫气体 | |
| B. | 明矾可用作净水剂、晶体硅用来制作光导纤维 | |
| C. | 稀硫酸中加入KNO3可使金属铜溶解 | |
| D. | 氯气通入品红溶液中溶液褪色,说明Cl2具有漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com