
| A. | K+ MnO4- Cl- SO42- | B. | Na+ AlO2- Cl- SO42- | ||
| C. | SO42-Na+ HCO3-Ba2+ | D. | Na+ NO3- NH4+ SO42- |
分析 碱性溶液中存在大量氢氧根离子,无色溶液中不存在有色的离子,
A.高锰酸根离子为有色离子,不满足溶液无色的条件;
B.四种离子之间不发生反应,都不与氢氧根离子反应,且为无色溶液;
C.钡离子和硫酸根离子反应生成硫酸钡沉淀;
D.铵根离子与氢氧根离子反应生成弱电解质一水合氨.
解答 解:无色溶液中不存在Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,碱性溶液中存在大量氢氧根离子,
A.MnO4-为有色离子,不满足溶液无色的要求,故A错误;
B.Na+、AlO2-、Cl-、SO42-之间不反应,都是无色离子,且都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.SO42-、Ba2+之间反应生成硫酸钡沉淀,在溶液中不能大量共存,故C错误;
D.NH4+与氢氧根离子反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题
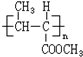 和高聚物H的合成路线如图:
和高聚物H的合成路线如图: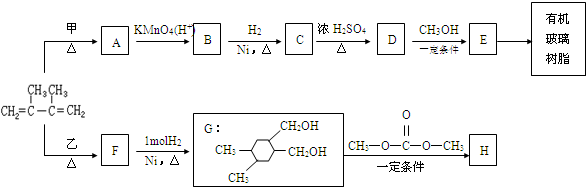
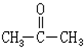 +CH3COOH
+CH3COOH
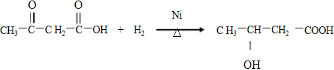 .
. .
.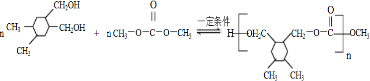 +(2n-1)CH3OH.
+(2n-1)CH3OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH2-CH2-CH2-CH3 | B. | HC≡C-CH2-CH2-CH2-CH3 | ||
| C. |  | D. | 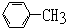 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
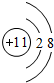
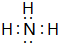 ,D单质能与水反应化学方程式是2Na+2H2O=2NaOH+H2↑.
,D单质能与水反应化学方程式是2Na+2H2O=2NaOH+H2↑.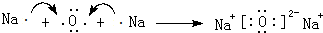 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:2 | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 该化合物中一定含有氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
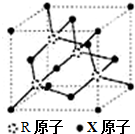 X、Y、Z、R为短周期元素,原子序数依次增大.X的基态原子的s能级电子数是p能级电子数的2倍;Y的单质在空气中含量最高;Z的氧化物是常见的两性氧化物;R基态原子最外层成对电子的数目和未成对电子的数目相等.
X、Y、Z、R为短周期元素,原子序数依次增大.X的基态原子的s能级电子数是p能级电子数的2倍;Y的单质在空气中含量最高;Z的氧化物是常见的两性氧化物;R基态原子最外层成对电子的数目和未成对电子的数目相等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二醇 | B. | 乙醇 | C. | 甲醇 | D. | 丙三醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com