
写出下列物质的电子式.
Na2O NaOH Na2O2
NH3 CO2 HClO .
考点:
电子式.
分析:
氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
氢氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷,氢氧根离子需要标出最外层电子;
过氧化钠中两个钠离子与过氧根离子通过离子键结合,两个氧原子通过共用1对电子结合;
氨气中存在3个氮氢键,氮原子最外层8个电子;
二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子;
HClO为共价化合物,分子中存在1个氧氢键和1个Cl﹣O键.
解答:
解:氧化钠为离子化合物,钠离子直接用离子符号表示,阳离子需要标出最外层电子及所带的电荷,氧化钠的电子式为: ;
;
氢氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,钠离子直接用离子符号表示,氢氧根离子需要标出最外层电子,氢氧化钠的电子式为: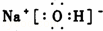 ;
;
Na2O2是离子化合物,由Na+离子和O2﹣离子构成,Na2O2的电子式为 ;
;
氨气中存在3个氮氢键,氮原子最外层8个电子,氨气的电子式为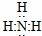 ;
;
CO2为共价化合物,二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: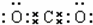 ;
;
HClO为共价化合物,分子中存在1个氧氢键和1个Cl﹣O键,次氯酸的电子式为: ;
;
故答案为: ;
;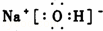 ;
; ;
;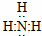 ;
; ;
;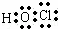 .
.
点评:
本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及正确的表示方法,明确离子化合物中阴离子需要标出最外层电子,阳离子直接用离子符号表示.


科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 摩尔是6.02×1023个结构微粒的集体 |
|
| B. | 0.012kg12C所含的原子数精确值是6.02×1023 |
|
| C. | 1molH就是1mol氢 |
|
| D. | 1molH2SO4的质量是98g |
查看答案和解析>>
科目:高中化学 来源: 题型:
电化学降解NO3﹣的原理如图所示,若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左﹣△m右)为a克,则a值为()
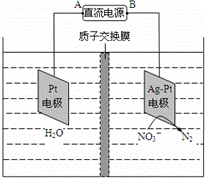
A. 14.4 B. 10.4 C. 12.4 D. 14.0
查看答案和解析>>
科目:高中化学 来源: 题型:
元素的性质随着元素原子序数的递增而呈周期性变化的原因是( )
|
| A. | 元素原子的核外电子排布呈周期性变化 |
|
| B. | 元素的原子半径呈周期性变化 |
|
| C. | 元素的化合价呈周期性变化 |
|
| D. | 元素的金属性、非金属性呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是()
A. 在稀溶液中,1mol酸和1mol碱完全反应所放出的热量,叫做中和热
B. 热化学方程式中,各物质前的化学计量数不表示分子个数
C. 在101kPa时,1mol物质燃烧时所放出的热量叫做该物质的燃烧热
D. 如果反应物所具有的总能量小于生成物所具有的总能量,则反应放热
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)⇌2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表.下列说法正确的是()
t/min 2 4 7 9
n(Y)/mol 0.12 0.11 0.10 0.10
A. 反应前2min的平均速率v(Z)=2.0×10﹣5mol/(L•min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:①2H2(g)+O2(g)=2H2O(l)△H=﹣570kJ/mol,
②H2(g)+ O2(g)=H2O(g)△H=﹣241.8kJ/mol,
O2(g)=H2O(g)△H=﹣241.8kJ/mol,
③C(g)+ O2(g)=CO (g)△H=﹣110.5KJ/moL,
O2(g)=CO (g)△H=﹣110.5KJ/moL,
④C(s)+O2(g)=CO2(g)△H=﹣393.5KJ/moL.回答下列各问:
(1)上述反应中属于放热反应的是
(2)C的燃烧热为
(3)燃烧10gH2生成液态水,放出的热量为 .
(4)CO的燃烧热为 ,表示CO燃烧热的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
断肠草为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构式,下列推断不正确的是( )
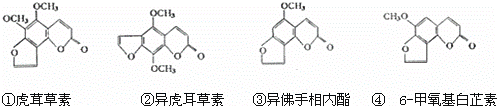
A. ①与②、③与④分别互为同分异构体
B. ①、③互为同系物
C. 等物质的量②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者多
D. ①、②、③、④均能与氢氧化钠溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com