
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知反应 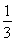 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g) 
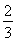 Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1. 0mol,反应经过l0min后达到平衡。
(1)CO的平衡转化率=____________
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
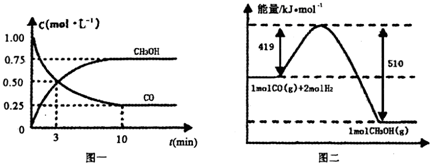
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g) CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
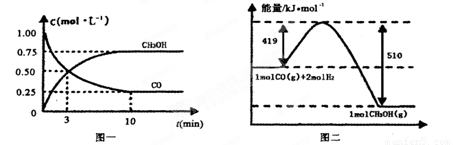
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
容器 | 反应物投入的量 | 反应物的 转化率 | CH3OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
则下列关系正确的是________
A.c1=c2????? B.2Q1=Q3??? C.2α1=α3?????? D.α1+α2 =1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
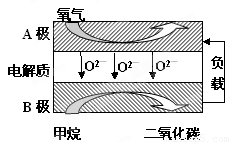
(1)B极上的电极反应式为????????????????????????????????????????????
(2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为???????????? (标况下)。
I.(1)60%(2分) ??? ???? (2)d(2分)
Ⅱ.(1)0.15mol/(L·min) (2分)(单位出错给1分)???
(2) A? D? E (3分,有错选不得分)
Ⅲ.(1)? CH4 + 4O2— —8e—= CO2+ 2H2O;(2分)?
(2)??? 1.12 L(2分)??????
【解析】
试题分析:I.(1)令平衡时CO的物质的量变化为nmol,则:
 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
 Fe(s)+ CO2(g)
Fe(s)+ CO2(g)
开始(mol):1???????????????? 1
变化(mol):n???????????????? n
平衡(mol):1-n??????????????? n+1
所以n+1/(1-n)=4,解得n=0.6,则CO的平衡转化率为0.6mol/1mol×100%=60%,故答案为:60%; (2)a.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故a错误;b.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故b错误;c.加入合适的催化剂,平衡不移动,故c错误;d.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故d正确;e.粉碎矿石,使其与平衡混合气体充分接触,平衡不移动,故e错误;故选d; III(1)达到平衡时生成甲醇为:0.75mol/L,则消耗的c(H2)=2×0.75mol/L=1.5mol/L,v(H2)=△c/△t=1.5mol/L/10min=0.15mol/(L min)(2)A、甲、乙相比较,把乙等效为开始加入1mol CO和2mol H2,和甲是等效的,甲乙是等效平衡,所以平衡时甲醇的浓度c1=c2,故A正确;B、甲、丙相比较,丙中反应物的物质的量为甲的2倍,压强增大,对于反应CO(g)+2H2(g) CH3OH(g),平衡向生成甲醇的方向移动,故2Q1<Q3,故B错误;C、甲、丙相比较,丙中反应物的物质的量为甲的2倍,压强增大,对于反应CO(g)+2H2(g)=CH3OH(g),平衡向生成甲醇的方向移动,故a1<a3 ,故C错误;D、甲、乙处于相同的平衡状态,而且反应方向相反,则α1+α2=1 ,故D正确;E、甲、乙处于相同的平衡状态,而且反应方向相反,两个方向转化的和恰好为1mol,所以该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量,故E正确;故答案为:ADE;Ⅲ.(1)通入燃料甲烷的电极是负极,通入氧气的电极是正极。负极发生的电极式为CH4 + 4O2——8e—= CO2+ 2H2O。(2)电解硫酸铜溶液时阳极的电极反应式4OH— —4e—= O2↑+ 2H2O,阴极的反应式是: Cu2++2e-=Cu;2H++e-=H2↑。N(Cu)=0.1mol.若两极收集到的气体体积相等,设其物质的量为X。则4X=0.1×2+2X。解得X=0.1.在整个反应过程转移电子相等。电子的物质的量为0.4mol.由于每摩尔甲烷失去电子8摩尔,所以需要甲烷的物质的量为0.05摩尔。V(CH4)=0.05摩尔×22.4升/摩尔=1.12 升 。实际上消耗的甲烷体积比理论上大,可能原因是甲烷不完全被氧化,生成C或CO? 或 电池能量转化率达不到100%。
考点:本题综合考查了化学平衡、电化学等知识,题目侧重于等效平衡的计算,为该题的难点,也是易错点,注意理解等效平衡问题。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| 3 |
| 2 |
| 1 |
| 3 |
| 2 |
| 3 |
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | a2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | a3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 化学常用计量练习卷(解析版) 题型:计算题
我国是个钢铁大国,钢铁产量居世界第一位,高炉炼铁是最为普遍的炼铁方法。某种矿石中铁元素以氧化物FemOn的形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用2 mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
(1)计算该铁矿石中铁元素的质量分数。
(2)计算氧化物FemOn的化学式(m、n为正整数)。
查看答案和解析>>
科目:高中化学 来源:2012年苏教版高中化学选修2 5.4 化学农药的发展练习卷(解析版) 题型:填空题
我国是个农业大国,农业是立国之本,“农村、农业、农民”是党中央新时期农村工作的重心,化肥与农药的发展起着巨大的推动作用,请回答下列问题:
(1)农作物生长过程中不可缺少的微量元素有Fe、Mn、B、Cu、Mo等,它们或是酶的组成成分,或能提高酶的活性,是农作物体内营养物质的形成和新陈代谢不可缺少的。常用铜肥是胆矾,在盐碱地(土壤pH>7)施用胆矾时宜将溶液________(填“喷在叶片上”或“随水灌入土壤中”),主要理由是_______________________________________________________
________________________________________________________________________。
(2)农药波尔多液是一种常用的杀菌剂,常用配方为胆矾、生石灰、水,按质量比1∶0.56∶100混合,分析其防治病虫害的原因________________________________________。
(3)拟除虫菊酯是一种高效、低毒,对昆虫有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图:

其分子式为________________________,则下列对该化合物的叙述正确的是________(填字母代号)。
A.该化合物属于芳香烃
B.该化合物属于卤代烃
C.该化合物在碱性条件下失去药效
D.该化合物在一定条件下可发生加成反应
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高一11月月考化学试卷(解析版) 题型:计算题
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。某种矿石中铁元素以氧化物FemOn的形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6g。剩下滤液用浓度为2mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0mL。
提示:2Fe3++Cu === 2Fe2++Cu2+ 8H++MnO4-+5Fe2+ === Mn2++5Fe3++4H2O
(1)计算该铁矿石中铁元素的质量分数。
(2)计算氧化物FemOn的化学式(m、n为正整数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com