
科目:高中化学 来源: 题型:
下列微粒在溶液中的还原性和氧化性强弱顺序如下:还原性HSO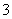 >I-,氧化性IO
>I-,氧化性IO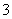 >I2>SO
>I2>SO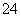 。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x=________mol。
。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x=________mol。

查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应X(g)+ Y(g) 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列有关该反应的说法中正确的是
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列有关该反应的说法中正确的是
| t / min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |

A. 反应前2min的平均速率v(Z)=2.0×10-3 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,达到平衡时,将容器体积缩小至5升,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.硅元素主要以单质、氧化物、硅酸盐的形式存在于自然界中
B.镁、铝具有一定的抗腐蚀性,是因为镁、铝不易被氧化
C.84消毒液的主要成分是NaClO
D.某些金属元素的焰色反应、海水提溴、煤的液化、石油的裂化都是化学变化的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、A12O3、CaO、MgO等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下:
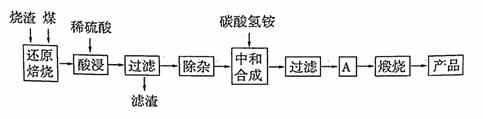
(1)在“还原焙烧”中产生的有毒气体可能有 。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是 (用离子方程式表示)。
(3)根据下表数据:
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于 ,检验Fe3+已经除尽的试剂是 ;常温下,当pH = 5时,溶液中c(Al3+)
= mol·L– 1(已知常温下Ksp[Al(OH)3] = 2.0×10– 33)。
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是 。
(5)a g烧渣经过上述工艺可得红氧化铁b g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于 (用含a、b的表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
同一短周期的元素W、X、Y、Z的原子序数依次增加、下列叙述正确的是
A.单质的化学活泼性:W<X<Y<Z B.原子最外层电子数:W<X<Y<Z
C.单质的氧化能力:W<X<Y<Z D.元素的最高化合价:W<X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.ⅠA族元素的金属性比ⅡA族元素的金属性强
B.第三周期元素的离子半径从左到右逐渐减小
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在极性共价键和非极性共价键的是( )
A.Z2Y B.X2Y2 C.Z2Y2 D.ZYX
查看答案和解析>>
科目:高中化学 来源: 题型:
MgSO4·7H2O是一种重要的化工原料。某研究性学习小组设计了利用菱镁矿石(主要成分是MgCO3,并含有MnCO3、SiO2杂质)制取MgSO4·7H2O的实验,流程如下。
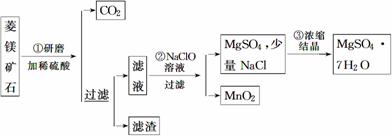
(1)第①步研磨的目的是____________________,所得滤液主要含__________________、__________________等溶质。
(2)第②步反应的离子方程式为_____________________________________________。
(3)第③步浓缩结晶后,要经过________、洗涤、干燥等步骤才可得到MgSO4·7H2O,洗涤沉淀的基本操作是______________________________________________________。
(4)若制得MgSO4·7H2O质量为82.00 g,测得MnO2质量为1.74 g,且测得第①步滤渣质量为4.70 g,忽略各物质在溶液中的溶解损失,可计算出菱镁矿石中MgCO3的质量分数为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com