
【题目】涤纶广泛应用于衣料和装饰材料。合成涤纶的反应如下:
![]()
下列说法正确的是
A. 合成涤纶的反应为加聚反应
B. 对苯二甲酸和苯甲酸互为同系物
C. 1 mol涤纶与NaOH溶液反应,理论上最多可消耗2n mol NaOH
D. 涤纶的结构简式为:![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】1 mol过氧化钠与2 mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A. Na2CO3 B. Na2O2、Na2CO3
C. NaOH、Na2CO3 D. Na2O2、NaOH、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用原电池原理可以处理硫酸工业产生的SO2尾气。现将SO2 通入如图装置(电极均为惰性材料)进行实验。下列说法不正确的是
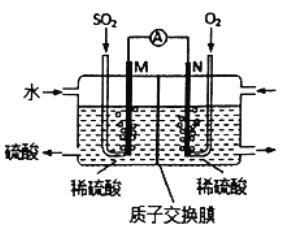
A. M极为负极,电极上发生氧化反应
B. 溶液中H+移向N区,SO42-移向M区
C. N极发生的电极反应为O2+4H++4e-=2H2O
D. 相同条件下,M、N两极上消耗的气体体积之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为CH2=CH-CH2-CH2OH,下列关于该有机物的叙述不正确的是( )
A. 能与金属钠发生反应并放出氢气
B. 能在催化剂作用下与H2发生加成反应
C. 能发生银镜反应
D. 在浓H2SO4催化下能与乙酸发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由3种常见短周期元素组成的化合物A,相对分子质量为119,能与水剧烈反应,生成2种酸性气体的混合气体B。现对化合物A进行下列实验,假设各步反应均完全,反应中气体完全逸出。
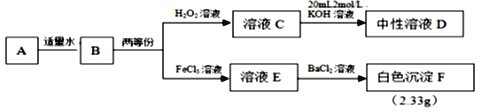
请回答:
(1)D中溶质的化学式_____________________,H2O2的电子式_______________。
(2)A和水反应的化学方程式___________________________________________。
(3)B→E的离子方程式______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为探究钠与二氧化碳的反应,利用如图装置进行实验。
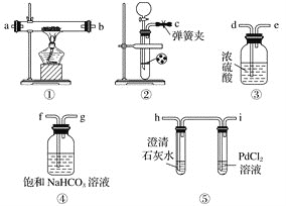
已知PdCl2能被一氧化碳还原得到黑色的Pd。请回答下列问题:
(1)请将上图各装置连接完整:c接f,______接______,______接______,______接______。
(2)若用稀盐酸与碳酸钙反应制备二氧化碳,在加稀盐酸时,发现碳酸钙与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向长颈漏斗中加入的试剂是______(填字母)。
A.硝酸钠溶液 B.四氯化碳 C.苯 D.稀硝酸
(3)检查装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让二氧化碳充满整个装置,当观察到________________时,再点燃酒精灯。此步操作的目的是________________________________。
(4)反应过程中二氧化碳足量,假如反应过程中有下列两种情况,分别写出两种情况下钠与二氧化碳反应的化学方程式。
Ⅰ.装置⑤PdCl2溶液中观察到有黑色沉淀,装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体: ___________________________。
Ⅱ.装置①中钠的质量为0.46 g,充分反应后,将装置①中的固体加入到足量稀盐酸中产生224 mL(标准状况)二氧化碳气体,且溶液中还有固体残留:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为______________。
②Fe的基态原子共有_________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4═2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是_____(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_____,中心原子的杂化方式为_____________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10﹣2 nm和7.8×10﹣2 nm.则熔点:NiO________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
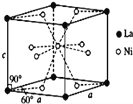
①该晶体的化学式为_____________。
②已知该晶胞的摩尔质量为M gmol﹣1,密度为d gcm﹣3.设NA为阿伏加德罗常数的值,则该晶胞的体积是_____ (用含M、d、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去粗盐中的杂质CaCl2、MgCl2和Na2SO4,过程如下:
![]()
下列有关说法中,不正确的是
A. 除去Mg2+的主要反应: Mg2++ 2OH-=Mg(OH)2↓
B. 试剂①一定不是Na2CO3溶液
C. 检验SO42-是否除净:取少量滤液,加稀盐酸酸化,再加BaCl2溶液
D. 滤液加稀盐酸时只发生反应: H+ +OH- =H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com