
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温度/℃ | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
(1)①写出工业合成氨的化学方程式:________________。
②由表中数据可知该反应为放热反应,理由是________。
③理论上,为了增大平衡时H2的转化率,可采取的措施是______
(填字母序号)。
a.增大压强
b.使用合适的催化剂
c.升高温度
d.及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的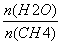 恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:
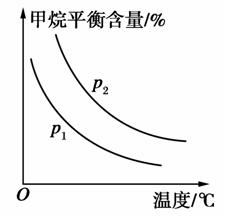
①图中,两条曲线表示压强的关系是p1________p2(填“>”、“=”或“<”)。
②该反应为________反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g)+H2O(g)CO2(g)+H2(g)获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为________该温度下反应的平衡常数K值为________。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容积固定为5 L的容器中进行反应,下列描述能够说明体系处于平衡状态的是________________(填字母序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO)n(H2O)n(CO2)n(H2)=11666
解析:本题考查了化学平衡及其移动、化学平衡常数的有关计算及其应用等,意在考查考生运用所学知识综合分析、解决问题的能力。(1)③合成氨反应为气体分子数减小的反应,故增大压强时平衡正向移动,a对;催化剂不能改变反应的限度,b错;合成氨反应为放热反应,升高温度平衡逆向移动,c错;及时分离出产物,减小了生成物的浓度,有利于反应正向进行,d对。(2)①在p2压强下的曲线上任意一点向下作垂线,由此看出相同温度时,压强为p1时甲烷平衡含量小,说明p1时反应限度大,而该反应为气体分子数增大的反应,故p1<p2。②由图像看出随温度升高,甲烷平衡含量减小,即升高温度,平衡正向移动,故该反应是吸热反应。
(3)①根据“三段式”:
CO(g)+H2O(g)CO2(g)+H2(g)
起始(mol·L-1) 0.2 0.2 0 0
转化(mol·L-1) 0.12 0.12 0.12 0.12
平衡(mol·L-1) 0. 08 0.08 0.12 0 12
平衡时CO的转化率: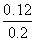 ×100%=60%,该温度下反应的平衡常数K=
×100%=60%,该温度下反应的平衡常数K=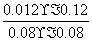 =
= 。②该反应为气体分子数不变的反应,无论反应是否达到平衡,压强均不变,a错;容器体积不变,且容器中气体的质量不变,故密度不变与反应是否达到平衡无关,b错;单位时间内生成a mol CO2的同时消耗a mol H2,相当于消耗a mol CO2的同时生成a mol CO2,正逆反应速率相等,说明反应达到平衡状态,c对;混合气体中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6,设n(CO)=x mol,则浓度商Qc=
。②该反应为气体分子数不变的反应,无论反应是否达到平衡,压强均不变,a错;容器体积不变,且容器中气体的质量不变,故密度不变与反应是否达到平衡无关,b错;单位时间内生成a mol CO2的同时消耗a mol H2,相当于消耗a mol CO2的同时生成a mol CO2,正逆反应速率相等,说明反应达到平衡状态,c对;混合气体中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6,设n(CO)=x mol,则浓度商Qc=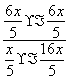 =
= =K,处于化学平衡状态,d对。
=K,处于化学平衡状态,d对。
答案:(1)①N2+3H2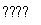 2NH3(2分) ②随温度升高,反应的平衡常数K值减小(2分) ③a、d(2分)
2NH3(2分) ②随温度升高,反应的平衡常数K值减小(2分) ③a、d(2分)
(2)①<(1分) ②吸热(1分)
(3)①60%(2分)  或2.25(2分) ②c、d(2分)
或2.25(2分) ②c、d(2分)


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
工业上制取ClO2的化学反应:2NaClO3 + SO2 + H2SO4 = 2ClO2 + 2NaHSO4,下列说法正确的是( )
A.SO2在反应中被还原 B.NaClO3在反应中失去电子
C.H2SO4 在反应中作氧化剂 D.1mol氧化剂在反应中得到1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:H2(g)+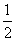 O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1,C(s)+
O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1,C(s)+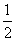 O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1。由此可知焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)===CO(g)+H2(g) ΔH3,则ΔH3为( )
O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1。由此可知焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)===CO(g)+H2(g) ΔH3,则ΔH3为( )
A.+131.3 kJ·mol-1 B.-131.3 kJ·mol-1
C.+352.3 kJ·mol-1 D.-352.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法正确的是( )
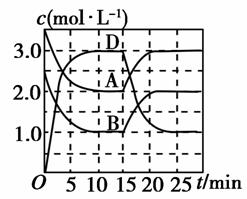
A.反应在前10 min的平均反应速率v(B)=0.1 mol·L-1·min-1
B.该反应的平衡常数表达式K=
C.若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D.反应至15 min时,改变的条件是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
将2 mol A和1 mol B充入V升的密闭容器中,在一定条件下发生反应:2A(g)+B(g)2C(g)。平衡时C的体积分数(%)随温度和压强的变化如下表所示:
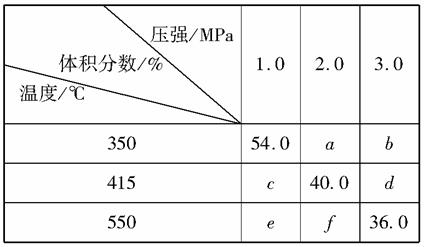
下列判断正确的是( )
A.b>e
B.415 ℃、2.0MPa时B的转化率为60%
C.该反应的ΔH>0
D.平衡常数K(550 ℃)>K(350 ℃)
查看答案和解析>>
科目:高中化学 来源: 题型:
氮的氧化物(用NOx表示)是大气污染物,必须进行处理。
(1)汽车尾气主要含有CO2、CO、SO2、NOx等物质,这种尾气逐渐成为城市空气污染的主要来源之一。
①汽车尾气中的CO来自于____________________,NO来自于_____________________。汽车尾气对环境的危害主要有________________________(至少填两种)。
②汽车尾气中的CO、NOx在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。反应的化学方程式可表示为__________________________。
(2)用氨可将氮氧化物转化为无毒气体。已知:4NH3+6NO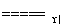 5N2+6H2O,8NH3+6NO2
5N2+6H2O,8NH3+6NO2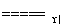 7N2+12H2O。同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气体完全转化为N2,则原混合气体中NO和NO2的体积之比是________。
7N2+12H2O。同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气体完全转化为N2,则原混合气体中NO和NO2的体积之比是________。
(3)工业尾气中氮的氧化物常采用碱液吸收法处理,若NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后得到一种钠盐,该钠盐的化学式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下将1.92 g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混合气体1.12 L,则反应消耗HNO3的物质的量为 ( )
A.0.8 mol B.0.6 mol
C.0.11 mol D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为________;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述不正确的是
A.标准状况下,33.6LCO2中含有氧原子数为3NA
B.1 mol OH-和1 mol -OH(羟基)所含质子数均为9NA
C.常温下,100mL 0.1 mol·L-1醋酸钠溶液中含醋酸根的数目小于0.01NA
D.50mL18.4 mol·L-1浓硫酸与足量铜加热反应,生成SO2分子数为0.46NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com